Согласно современным представлениям, атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. Ядро образовано двумя видами элементарных частиц — положительно заряженными протонами р+ и незаряженными нейтронами n0, вместе они называются нуклонами. Число нуклонов в ядре атома равно массовому числу А:

Число протонов в ядре равно атомному (порядковому) номеру Z химического элемента в Периодической системе элементов Д.И. Менделеева. Следовательно, положительный заряд ядра определяется атомным номером элемента. Поскольку атом в целом электронейтрален, то число электронов в атоме равно числу протонов в атомном ядре:

Практически вся масса атома сосредоточена в ядре, так как масса электронов чрезвычайно мала (mэ ≈ 1/2000 mр+).
Все атомы одного и того же элемента, имея один и тот же заряд ядра, могут отличаться по массе. Разновидности атомов одного и того же химического элемента, различающиеся по массе, называются изотопами. Различие в массе связано с различным числом нейтронов в ядре. Так, водород имеет 3 изотопа, которые обозначаются так:

где заряд ядра указан слева внизу, а массовое число — слева вверху. Ядро самого легкого изотопа (протия) не содержит нейтронов, ядро дейтерия содержит 1 нейтрон, ядро трития — 2 нейтрона. Приведенные в Периодической системе значения атомных масс элементов учитывают содержание всех изотопов данного элемента в природе. Так, элемент хлор представлен в природе двумя изотопами: 1735Cl (примерно 75%) и 1737Cl (примерно 25%). Отсюда атомная масса природного хлора равна: 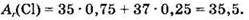
Область околоядерного пространства, в которой вероятность нахождения электрона наиболее высока, называют атомной орбиталью. Каждой атомной орбитали отвечает своя форма электронного облака. Известны s, р, d и f-атомные орбитали; так же называются и электроны, занимающие эти орбитали. Электронное облако s-орбитали имеет сферическую симметрию, р-электронные облака (рис. 1) напоминают вытянутую объемную восьмерку, форма d-облаков более сложная.

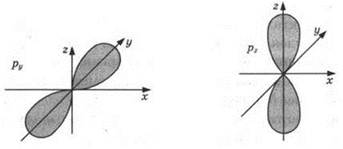
Рис. 1. s- и р-орбитали
Изучение атомных спектров показало, что электроны в атоме обладают разным запасом энергии, распределяясь по отдельным энергетическим уровням и подуровням. Энергетические уровни (или электронные оболочки) обозначают цифрами или латинскими буквами (табл. 1)

Каждый энергетический уровень включает в себя электроны с близкой энергией и состоит из нескольких энергетических подуровней, которые состоят из электронов с одинаковой энергией. Число подуровней в уровне равно номеру данного уровня. Так, первый уровень состоит всего из одного подуровня, обозначаемого 1s-подуровень. Второй уровень состоит из двух подуровней — 2s и 2р. Третий уровень включает в себя три подуровня — 3s, 3р и 3d. Четвертый подуровень включает в себя четыре подуровня — 4s, 4р, 4d и 4f. Электроны на ближайшем к ядру энергетическом уровне (n = 1) обладают наименьшей энергией. По мере увеличения номера уровня запас энергии электронов возрастает. Для данного энергетического уровня энергия s-подуровня наименьшая, а энергия f-подуровня — наибольшая:

Любой из s-подуровней включает в себя одну s-атомную орбиталь, р-подуровень включает три р-орбитали, d-подуровень содержит пять d-орбиталей.
Электронная конфигурация показывает распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям. Электронная конфигурация составляется в соответствии с принципом минимума энергии: вначале электронами заполняются атомные орбитали с наименьшей энергией, расположенные ближе к ядру.
Экспериментально установлено, что атомные орбитали заполняются электронами в следующем порядке:

Составляя электронную формулу атома, сначала цифрой указывают номер энергетического уровня, затем буквой (s, р, d, f) обозначают подуровень и, наконец, указывают число электронов на данном подуровне (верхний индекс). Так, запись 1s2 означает, что на 1s-подуровне находятся два электрона.
Для составления электронной формулы любого атома достаточно знать порядковый номер элемента в Периодической системе (это дает число электронов в атоме), номер периода (указывает на число энергетических уровней, заполняющихся электронами) и приведенную выше последовательность заполнения атомных орбиталей электронами.
Первый период содержит два элемента — водород и гелий. Атом водорода имеет один электрон, а атом гелия — два электрона, располагающихся на 1s-подуровне, что записывается электронными формулами:

Второй период начинается элементом литием и заканчивается неоном. Он включает 8 элементов. Все электроны в атомах элементов второго периода располагаются на двух энергетических уровнях:
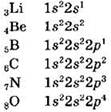
Третий период включает 8 элементов: 2 — s-элемента и 6 p-элементов. Все электроны в атомах элементов третьего периода располагаются на трех энергетических уровнях.

Однако следует помнить, что число элементов, у которых электроны располагаются на трех энергетических уровнях, равно 18.
Четвертый период начинается, как и другие периоды, с s-элементов — калия и кальция, в атомах которых происходит заполнение электронами 4s-орбиталей. И только после заполнения 4s-оболочки происходит заполнение вакантной 3d-оболочки. Первый 3d-электрон появляется в атоме скандия:

(сначала заполняется 4s-подуровень, а записывается в электронной формуле сначала 3d-подуровень).
Скандий и последующие элементы называются 3d-элементами, всего их десять (так как на пяти d-орбиталях может максимально разместиться 10 электронов), d-элементы наряду с f-элементами относятся к так называемым переходным элементам, которые всегда располагаются в побочных подгруппах Периодической системы.
Электронные конфигурации переходных элементов четвертого периода:
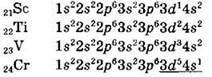

Обратите внимание на электронные конфигурации атомов хрома и меди. Вместо конфигурации 3d44s2 атом хрома имеет конфигурацию 3d54s1. Это связано с переходом одного из 4s-электронов на 3d-подуровень вследствие близости энергий 4s и 3d-подуровней, что приводит к повышенной устойчивости наполовину заполненной d-оболочки. Аналогичный “провал электрона” имеет место и в атоме меди, что также связано с повышенной устойчивостью полностью заполненной d-оболочки.
Мы рассмотрели электронные конфигурации атомов, находящихся в основном состоянии. Основное состояние — самое устойчивое, в нем атом может находиться бесконечно долго. Кроме основного состояния, существуют и возбужденные состояния атома. Сообщив атому небольшую энергию, можно перевести электрон на соседнюю вакантную орбиталь того же уровня или даже уровень с большей энергией. В возбужденном состоянии атом может находиться ничтожно малое время, не больше 10-8 с, после чего вновь переходит в устойчивое основное состояние.
 2020-04-20
2020-04-20 2098
2098