При l =0, т.е. на s-подуровне, имеется всего одна орбиталь, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой: 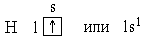
В атоме гелия, порядковый номер которого в периодической системе (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия: 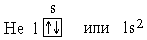
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента Li (Z =3) третий электрон уже не может разместиться на орбиталиK-слоем называется первый электронный слой атома.: это противоречило бы принципу Паули, поэтому он занимает s-состояние второго энергетического уровняL-слоем называется второй электронный слой атома.. Его электронная структура записывается формулой 1s22s1,
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота
Принцип Паули (1925): В атоме не может быть двух электронов у которых все 4 квантовых числа были бы одинаковы. Хотя бы одно из квантовых числе n,l,m,s должно отличаться. Они будут отличаться спинами. Если спины двух чисел одинаковы значит они отличаются одним из квантовых числом.
Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией. Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1S орбитали и третий электрон не может занимать 1S орбиталь, так как будет нарушен запрет Паули. Поэтому, третий электрон занимает 2S орбиталь (следующая, низшая по энергии, орбиталь после 1S).
 2018-01-21
2018-01-21 1115
1115
