В качестве рабочего тела тепловых машин часто используют смеси газов. Компонентами смеси называют любую химически различную (состоящую из одних молекул: химический состав постоянен, химические реакции отсутствуют) составляющую смеси. Молекулы такой составляющей химически независимы. Или компонентами смеси называются чистые вещества, составляющие смесь. Чистым веществом называется вещество, все молекулы которого одинаковы (вода, спирты, азот, аммиак)
Смеси идеальных газов также являются идеальным газам и подчиняются всем законам идеальных газов.
Используют следующие способы задания состава смеси:
1) парциальными давлениями рi:
Парциальным называют давление, которое имела бы данная i – компонента при температуре смеси Tсм и объеме, равному объему смеси Vсм, состоящей из n компонент. Согласно закону Дальтона давление смеси равно сумме парциальных давлений компонент, составляющих эту смесь

2) парциальными (или приведенными) объемами Vi или объемными долями 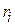 :
:
Парциальным (приведенным) называют объем, который заняла бы компонента при температуре и давлении, равных температуре и давлении смеси.
 ;
;  ;
; 
3) массами компонент Mi или массовыми долями компонент mi:
 ;
;  ;
; 
4) числом молей Ni или мольными долями xi:
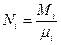 ;
; 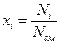 ;
; 
Соотношения между способами задания смеси:
1) соотношение между объемными ri и мольными долями x i:

Для химически не реагирующих газов объемные и мольные доли численно равны.
2) между массовыми долями mi и объемными ri долями:

т.к. 

3) расчет парциального давления компонент в смеси pi.
Запишем уравнение состояния для компоненты, используя понятия pi и Vi
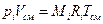



Таким образом,

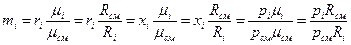

Для того, чтобы к газовой смеси применить уравнение состояния, необходимо знать газовую постоянную смеси Rсм и массу моля смеси μсм, то есть расчет смеси сводится к расчету Rсм и μсм. Любую из этих констант при заданном составе можно определить как следствия из вышеприведенных уравнений:

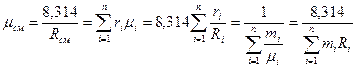
Пример задачи:
Имеется два баллона по 40 л, имеющих равную температуру. В первом баллоне под давлением 5 МПа (абс.) находится СО2. Во втором баллоне находится 5 кг О2. Баллоны объединили в единую систему, газы перемешались до гомогенного состояния. Найти: газовую постоянную полученной смеси R; мольную массу μ, мольный и массовый состав смеси (ri и gi).
Решение задачи:
1) находим массы каждого газа.
СО2: из уравнения состояния pV=MRT MCO2=pV/RCO2T
RCO2=8,314/(12+16*2)=188,95
МСО2=5*106*40*10-3/188,95*300=3,53 кг
2) находим массовые доли каждого компонента:
gCO2=MCO2/(MCO2+MO2)=3.53/(5+3.53)=0.41
gO2= 1-gCO2=MO2/(MCO2+MO2)=5/(5+3.53)=0.59
3) Находим газовую постоянную
Rсм= RCO2 gCO2+ RO2 gO2=188,95*0,41+(8314/32)*0,59=230,76
4) Находим мольную массу смеси:
μсм=8,314/Rсм=36,03
 2020-04-07
2020-04-07 767
767








