Тема 1.3. Химическая кинетика и катализ. Химическое равновесие
Цели
· усвоить основы кинетики химических реакций и катализа; научные основы оптимальных режимов технологических процессов приготовления пищи, условия хранения пищевого сырья и готовой продукции; влияние ферментов на течение физиологических, биологических "процессов, технологических процессов приготовления пищи.
· Изучить сущность фазового и химического равновесия; рассмотреть фазовые переходы и фазовые диаграммы однокомпонентных систем; правило фаз.
· Изучить принцип Ле Шателье и направление смещения химического равновесия в зависимости от различных факторов.
План
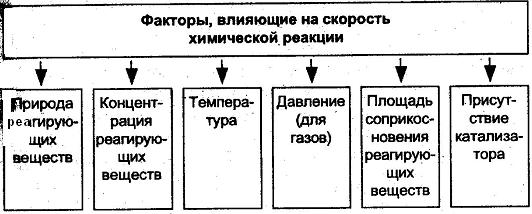
§ 1.3.1. Скорость химических реакций. Факторы, влияющие на скорость
§ 1.3.2. Влияние природы реагирующих веществ на скорость
§ 1.3.3. Влияние концентрации на скорость
§ 1.3.4. Влияние температуры на скорость
§ 1.3.5. Скорость реакции в гетерогенных системах
§ 1.3.6. Катализ и катализаторы
§ 1.3.7. Гомогенный катализ
§ 1.3.8. Гетерогенный катализ
§ 1.3.9. Ферментативный катализ
§ 1.3.10. Фазовые переходы. Фазовое равновесие
§ 1.3.11. Однокомпонентные системы. Фазовые диаграммы однокомпонентных систем
§ 1.3.12. Фазовые диаграммы двухкомпонентных систем
§ 1.3.13. Химическое равновесие
§ 1.3.14. Смещение химического равновесия
Вопросы для самопроверки
Скорость химических реакций.
Факторы, влияющие на скорость
Кинетика — учение о скорости и механизме химических реакций.
Вопрос о скорости химической реакции имеет большое практическое и теоретическое значение. От скорости реакций зависит течение биохимических процессов в организме, физико-химические изменения пищевых продуктов при тепловой обработке, производительность заводской аппаратуры.
Скорость химических процессов можно регулировать, изменяя условия их протекания. В некоторых случаях желательно интенсифицировать процесс, чтобы получить больше продукта в единицу времени. Иногда требуется уменьшить скорость химической реакции, например, замедлить окисление жиров в пищевых продуктах. Все эти задачи можно решить, применяя законы химической кинетики.
Скорость реакции — изменение концентрации реагирующих веществ в единицу времени.
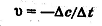
где — 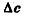 изменение концентрации реагирующих веществ,
изменение концентрации реагирующих веществ,
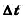 —промежуток времени.
—промежуток времени.
Так как скорость реакции всегда положительна, а изменение концентрации исходных веществ отрицательно, потому что в ходе химической реакции вещества расходуются, то в математическом выражении скорости ставят знак минус. Знак минус в уравнении показывает, что скорость химической реакции — величина убывающая.
 2020-04-12
2020-04-12 90
90







