Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральной и кислой средах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (–0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий – катодом.
Анодный процесс:
Zn0-2ē→Zn2+;
катодный процесс:
в кислой среде 2Н+ + 2ē → Н2;
в нейтральной среде О2+Н2О+4ē→ОН-.
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2.
Пример 2. 1. Склепаны два металла. Укажите, какой из металлов подвергается коррозии: а) Mn – Al; б) Sn – Bi.
Решение. а) Al в ряду напряжений находится перед марганцем и имеет более отрицательное значение стандартного электродного потенциала, поэтому при контакте этих двух металлов Al будет анодом, а Mn - катодом. Окисляться, т. е. подвергаться коррозии, будет алюминий.
б) В этом случае корродировать будет олово, т. к. в ряду напряжений оно расположено впереди висмута и, следовательно, является электрохимически более активным.
Пример 3. Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt, Al, Cu, Hg?
Решение. Анодное покрытие – это нанесение на защищаемое изделие электрохимически более активного металла. Из перечисленных металлов электрохимически более активным (по сравнению со свинцом) является алюминий (см. ряд напряжений металлов).
Пример 4. Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti, Mn, Ag, Cr?
Решение. Катодное покрытие – это нанесение на защищаемое изделие электрохимически менее активного металла. Из перечисленных металлов электрохимически менее активным (по сравнению со свинцом) является серебро (см. ряд напряжений металлов).
Пример 5. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в нейтральную среду при рН 7? Подсчитайте ЭДС коррозионного элемента при стандартных условиях. При каких значениях рН прекратится процесс выделения водорода?
Решение. Равновесные потенциалы водорода и кислорода, при их парциальных давлениях равных, определяем по уравнениям:
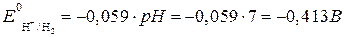 ,
,
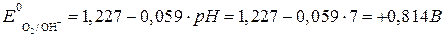 .
.
ЭДС коррозионных микроэлементов равны:
 – процесс с выделением водорода возможен
– процесс с выделением водорода возможен
2Н2О + 2е → 2ОН- + Н2
 – процесс с поглощением кислорода возможен
– процесс с поглощением кислорода возможен
1/2О2 + Н2О + 2е → 2ОН-.
Процесс выделения водорода прекратится, если Е' < 0, т. е. – 0,059 рН – (-0,763) < 0, откуда следует, что при рН < 12,9 Е' < 0; при этом процесс будет иметь место при любых значениях рН.
 2020-04-12
2020-04-12 275
275








