Электрохимическая коррозия металлов и защита от нее
Лабораторная работа № 3. Электрохимическая коррозия углеро-дистой стали (или чугуна)
Углеродистая сталь и чугун представляют собой сплавы железа с углеродом (содержат свободный углерод и цементит Fe3C). Содержание углеродных соединений в стали не превышает 1,3-2 %, а в чугуне – выше 2 %. Такие металлические материалы подвергаются всем видам атмосферной коррозии, а также жидкостной химической и электрохимической коррозии. В связи с этим при хранении пластинок на воздухе на их поверхности образуются оксиды железа и ржавчина.
В настоящей лабораторной работе рассматривается электрохимическая коррозия углеродистой стали или чугуна при контакте с нейтральным раствором электролита – раствором соли NaCl.
Реактивы и материалы: стальная или чугунная пластинка; коррозионная среда, содержащая 3 %-й раствор NaCl и индикаторы – красную кровяную соль K3[Fe3+(CN)6] и фенолфталеин (заранее готовится раствор 0,1 г красной кровяной соли, 3 г NaCl и 5 капель спиртового раствора фенолфталеина в 100 см3 воды).
Посуда и принадлежности: наждачная бумага, фильтровальная бумага.
Методика проведения опыта. Для очистки поверхности металла от оксидов железа и ржавчины зачистите пластинку наждачной бумагой до блеска, промойте проточной водой и высушите фильтровальной бумагой. Затем положите пластинку зачищенной стороной на фильтровальную бумагу, предварительно пропитанную коррозионной средой (состав см. выше) и слегка придавите. Через 3 мин пластинку уберите, зафиксируйте цвет, форму и распределение образовавшихся на пластинке пятен.
Красная кровяная соль представляет собой комплексную соль, содержащую катионы Fe3+. Красная кровяная соль при взаимодействии с катионами Fe2+, образующимися в процессе электрохимической коррозии железа, превращается в осадок синего цвета. Он представляет собой новое комплексное соединение синего цвета, называемое турнбулевой синью. Таким образом, красная кровяная соль выполняет роль индикатора для обнаружения катионов, которые образуются в опыте в результате окисления железа в процессе электрохимической коррозии по реакции
Fe0 – 2e → Fe2+
В основе действия красной кровяной соли как индикатора на катионы Fe2+ лежит обменная реакция, в ходе которой происходит изменение только во внешних сферах комплексных солей:
Fe2+X2 + K3[Fe3+(CN)6] → KFe2+[Fe3+(CN)6] + 2KX
красная кровяная соль турнбулева синь
С учетом полученных в работе результатов:
– объясните, какой процесс и почему проходит при контакте углеродистой стали или чугуна с раствором NaCl;
– отобразите схему этого процесса и запишите уравнения прошедших реакций.
Лабораторная работа № 4. Влияние природы металлов на контактную электрохимическую коррозию в кислой среде и протекторная защита стали
Реактивы и материалы: две канцелярские скрепки из стали, медная монета, гранула (пластинка) цинка, 0,2 Н раствор H2SO4, раствор красной кровяной соли K3[Fe3+(CN)6] – индикатора на катионы Fe2+ (см. лабораторную работу 2).
Посуда и принадлежности: два химических стакана на 50 см3.
Методика проведения опыта. Закрепите в одной скрепке медную монету, а в другой – гранулу цинка; в стаканы налейте по 5 см3 раствора серной кислоты, добавьте по три капли раствора красной кровяной соли и опустите в них скрепки: в один – с закрепленной медной монетой, в дру-гой – с закрепленным цинком.
Отметьте, в какой из пробирок появился осадок синего цвета, обусловленный образованием турнбулевой сини, а в какой – ярко-желтый осадок, обусловленный образованием комплексной соли цинка при взаимодействии катионов цинка с красной кровяной солью.
Составьте схемы коррозионных микрогальванических элементов и уравнения реакций на аноде, катоде и в реакционной среде в обоих случаях.
Объясните причину появления синей окраски только в одной пробирке, и как это согласуется с различной термодинамической неустойчивостью испытанных металлов (Fe, Cu, Zn) к электрохимической коррозии (для этого приведите значения их стандартных электродных потенциалов).
Укажите, какой из металлов в рассматриваемых условиях вообще не будет разрушаться и почему. Объясните, в каких условиях и в контакте с каким металлом этот металл стал бы подвергаться коррозионному разрушению. Приведите схему его коррозии в этом случае.
Определите, будет ли подвергаться стальная скрепка коррозии в кислой среде при отсутствии ее контакта с любым другим металлом. Свой ответ обоснуйте и приведите соответствующую схему (какой вид коррозии будет наблюдаться в этом случае?).
Оцените и обоснуйте возможность использования меди и цинка для защиты стали от электрохимической коррозии. Укажите, как называется такой вид противокоррозионной защиты и объясните ее сущность.
Лабораторная работа 5. Электрохимическая коррозия железа в условиях неодинаковой аэрации
Разная концентрация деполяризатора О2 в объеме капли (неодинаковая аэрация) приводит к тому, что в приповерхностной области капли (там, где концентрация О2 максимальная) наиболее быстро протекает процесс химической коррозии металла, приводящий к образованию смешанных оксидов железа общей формулы Fe3O4:
3Fe + 2O2 → FeO + Fe2O3.
Оксид железа, являясь полупроводником, в последующем процессе электрохимической коррозии выполняет роль катода на участке, контактирующем с электролитом.
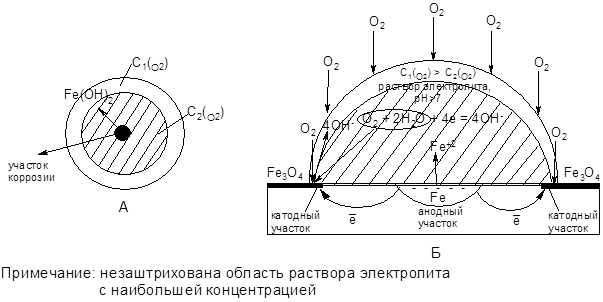
Под центром капли, в области наименьшей концентрации О2, образование защитной пленки оксида железа наиболее затруднено. Эта область поверхности чистого железа выполняет роль анода, так как имеет отрицательное значение электродного потенциала (рис. 5.1).
Рисунок 5.1 – Коррозия железа под неподвижной каплей воды: А – вид сверху, Б – вид в разрезе капли
Реагенты: заранее приготовленный 3 %-й раствор хлорида натрия NaCl, к которому предварительно добавлены раствор красной кровяной соли К3[Fe(CN)6] (2 % по массе) и раствор фенолфталеина; железная плоская пластинка.
Принадлежности: наждачная бумага, фильтровальная бумага.
Методика проведения опыта: Зачистите железную пластинку наждачной бумагой, промойте водой и высушите фильтровальной бумагой. На пластинку, находящуюся в горизонтальном положении, нанесите каплю раствора NaCl (диаметром 1-1,5 см), к которому предварительно были добавлены раствор красной кровяной соли и фенолфталеин. Оставьте пластину с каплей в неподвижном состоянии на 3-5 мин. В процессе опыта наблюдайте, в каких областях капли и какие окрашивания появляются.
Отразите наблюдения в лабораторном журнале, составьте и изобразите схему коррозии железа в условиях неодинаковой аэрации (см. рис. 5.1). Напишите реакции, проходящие на анодном и катодном участках железной пластины.
В выводах объясните:
– почему капля воды по периметру окрасилась в розовый цвет, а в центре капли появилось синее окрашивание;
– какую роль в проведенном опыте выполняют раствор NaCl, раствор красной кровяной соли и фенолфталеин;
– каким образом неодинаковая аэрация влияет на процесс коррозии технологического оборудования;
– на каком технологическом этапе процесса нефтедобычи имеет место этот вид коррозии.
 2020-04-12
2020-04-12 1743
1743