Решение.
В целом, комплексное соединение нейтрально. Составим уравнение, в котором заряд иона кобальта обозначим через x:
[Co(H2O)6)]Cl2
x + 6·0 + 2·(-1) = 0
x = +2
Co+2
[Co(NH3)6]Cl3
x + 6·0 + 3·(-1) = 0
x = +3
Co+3
Координационное число в обоих соединениях равно к.ч. = 6
Задача 2. Приведите схемы диссоциации и выражения констант нестойкости следующих комплексных ионов:
а) [Fe(CN)6]4-; б) [Ag(NH3)(H2O)]+; в) [Cr(H2O)6]3+.
Определите степень окисления указанных комплексообразователей.
Решение.
Обозначим степень окисления центрального атома через х:
а) [Fe(CN)6]4-;
х + 6(-1) = -4
х = +2
[Fe(CN)6]4- = Fe2+ + 6CN—
Kн = ([Fe2+]· [CN—]6)/ [[Fe(CN)6]4-]
б) [Ag(NH3)(H2O)]+;
х + 0 + 0 = +1
х = +1
[Ag(NH3)(H2O)]+ = Ag+ + NH3 + H2O
Kн = ([Ag+]·[NH3]·[H2O])/ [[Ag(NH3)(H2O)]+]
в) [Cr(H2O)6]3+
х + 6(0) = +3
х = +3
[Cr(H2O)6]3+ = Cr3+ + 6H2O
Kн = ([Cr3+]· [H2O]6)/ [[Cr(H2O)6]3+]
Задача 3. Укажите названия соединений, определите степень окисления комплексообразователя:
а) [Cr(NH3)6]Cl3; б) [Cu(NH3)4]SO4; в) K4[Fe(CN)6]; г) Na2[Be(OH)4]; д) [Co(NH3)3Cl3];
е )K[Pt(NH3)Cl3].
Составьте уравнения электролитической диссоциации перечисленных веществ и запишите соответствующие им выражения констант нестойкости комплексных ионов.
Решение.
Чтобы определить степень окисления центрального атома, необходимо решить простое уравнение, обозначив через х степень окисления комплексообразователя:
а) [Cr(NH3)6]Cl3 – хлорид гексаамминхрома (III)
х + 6·0 + 3·(-1) = 0
х = +3
[Cr(NH3)6]Cl3 = [Cr(NH3)6]3+ + 3Cl—
[Cr(NH3)6]3+ = Cr3+ + 6NH3
Kн = ([Cr3+]·[NH3]6)/[[Cr(NH3)6]3+]
б ) [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
х + 4·0 + 1·(-2) = 0
х = +2
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
[Cu(NH3)4]2+ = Cu2+ + 4NH3
Kн = ([Cu2+]·[NH3]4)/[[Cu(NH3)4]2+]
в) K4[Fe(CN)6] – гексацианоферрат(II) калия
4·1 + х + 6·(-1) = 0
х = +2
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4-
[Fe(CN)6]4- = Fe2+ + 6CN—
Kн = ([Fe2+]·[CN]6)/[[Fe(CN)6]4-]
г) Na2[Be(OH)4] – тетрагидроксоберрилат(II) натрия
2·1 + х + 4·(-1) = 0
х = +2
Na2[Be(OH)4] = 2Na+ + [Be(OH)4]2-
[Be(OH)4]2- = Be2+ + 4OH—
Kн = ([Be2+]·[OH—]4)/[[Be(OH)4]2-]
д) [Co(NH3)3Cl3] – триамминтрихлорокобальтат(III)
х + 3·0 + 3·(-1) = 0
х = +3
[Co(NH3)3Cl3] = Co3+ + 3NH3 + 3Cl—
Kн = ([Co3+]·[NH3]3·[Cl—]3)/[[Co(NH3)3Cl3]]
е) K[Pt(NH3)Cl3] – амминтрихлороплатинат(II) калия
1·1 + х + 1·0 + 3·(-1) = 0
х = +2
K[Pt(NH3)Cl3] = K+ + [Pt(NH3)Cl3]—
[Pt(NH3)Cl3]— = Pt2+ + NH3 + 3Cl—
Kн = ([Pt2+]·[NH3]·[Cl—]3)/[[Pt(NH3)Cl3]—]
Задача 4. Напишите формулы комплексных соединений по указанным названиям:
А) хлорид тетраамминцинка (II), б) тетраиодокобальтат (III) натрия.
Решение.
а) хлорид тетраамминцинка (II) – [Zn(NH3)4]Cl2
б) тетраиодокобальтат (III) натрия — Na[CoI4]
II. Выполнение контрольного задания
Назовите комплексные соединения. Приведите схемы диссоциации и выражения констант нестойкости комплексных ионов. Определите степень окисления комплексообразователей.
Вариант 1 Вариант 2
а) K[AuBr4] a) K[Pt(NH3)Cl5]
б) [Cd(NH3)](OH)2 б) H[Co(CN)4(H2O)2]
в) Na3[Ag(S2O3)2] в) Cu2[Fe(CN)6]
Практическая работа
РАССТАНОВКА КОЭФФИЦИЕНТОВ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Цель: научиться расставлять коэффициенты методом электронного баланса
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1. Основные теоретические положения
В основе метода электронного баланса лежитследующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1.Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2.Далее определим какие из соединений являются окислителем и восстановителем; найдем их степень окисления в начале и конце реакции:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3.Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 ¦ 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 ¦ 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4.Далее надо уравнять количества атомов элементов, не изменяющих степень окисления, в такой последовательности: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
5.Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Задание 1
а) Реакция изображена схемой: H2S + Cℓ2 + H2O → H2SO4 + HCℓ
Составьте электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое восстанавливается.
Решение
H2S + Cℓ2 + H2O → H2SO4 + HCℓ
 S2—8e→S+6 8 1-процесс окисления
S2—8e→S+6 8 1-процесс окисления
Cℓ2+2e→2 Cℓ- 2 4-процесс восстановления
H2S + 4Cℓ2 + 4H2O → H2SO4 + 8HCℓ
H2S-восстановитель, окисляется; Cℓ2-окислитель, восстанавливается
б) H2S + Сl2 + Н2О → H2SO4 + HCl
в) К2Сr2О7 + HCl → Cl2 + CrCl3 + KCl + H2O
г) Р + HClO3 + Н2О → Н3РО4 + HCl
д) FeS + HNO3 → Fe(NO3)2 + S + NO + H2O
е) KClO3 + Na2SO3 → KCl + Na2SO4
ж) Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O
з) HNO3 + Zn → N2O + Zn(NO3)2 + H2O
и) KCℓO3 + Na2SO3 → KCℓ + Na2SO4
к) KМnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
3.Выполнение контрольного задания
Вариант 1
Реакция изображена схемой:
а) I2 + Cl2 + H2O → HIO3 + HCl
б) Na2SO3 + KIO3 + H2SO4 → Na2SO4 + I2 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, каное вещество является окислителем, какое - восстановителем; каное вещество окисляется, каное восстанавливается.
Вариант 2
Реакция изображена схемой:
а) H2SO3 + HClO3 → H2SO4 + HCl
б) SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 +H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, каное вещество является окислителем, какое - восстановителем; каное вещество окисляется, каное восстанавливается.
Практическая работа
РАССТАНОВКА КОЭФФИЦИЕНТОВ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ МЕТОДОМ ПОЛУРЕАКЦИЙ
Цель: научиться расставлять коэффициенты методом электронного баланса
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1.Основные теоретические положения
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления. При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы: H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
- Запишем уравнение в ионном виде, сократив те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
- Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+, образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
- Находим коэффициент для окислителя и восстановителя, учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O ¦2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ ¦5 восстановитель, процесс окисления
- Затем необходимо просуммировать обе полуреакции, предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
- Запишем молекулярное уравнение, которое имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— ¦2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O ¦3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2 MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
И еще один пример — составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 ¦2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O ¦1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Задание 1
а) Реакция изображена схемой: H2S + Cℓ2 + H2O → H2SO4 + HCℓ
Составьте ионно-электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое восстанавливается.
б) FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O.
в) FeSО4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
г) КМnO4 + Na2SO3 + KOH → К2МnO4 + Na2SO4 + H2O
д) Cr2O3+ KNO3+ KOH→K2CrO4+KNO2+H2O
е) Na2SO3+ КМnO4+ H2O → Na2SO4+ MnO2+ KOH
ж) MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O.
з) K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
3.Выполнение контрольного задания
Вариант 1
Реакция изображена схемой:
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 +H2O
Составьте ионно-электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое восстанавливается.
Вариант 2
Реакция изображена схемой:
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O Составьте ионно-электронные уравнения. Расставьте коэффициенты в уравнении реакции. Укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое восстанавливается.
Практическая работа
ВЫЧИСЛЕНИЯ ВЕСОВОГО АНАЛИЗА
Цель: научиться проводить расчеты при определениях весового анализа
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1. Основные теоретические положения
Осаждаемая форма – соединение, в виде которого определяемый компонент осаждают в анализируемом растворе
Гравиметрическая (весовая) форма – соединение, которое взвешивают для получения конечного результата анализа.
Расчет результатов гравиметрического анализа выполняют по формуле:
mопределяемого вещества = mграв.ф· F, где F-гравиметрический фактор
Гравиметрический фактор (F) – отношение молярной массы определяемого компонента к молярной массе гравиметрической формы.
F = 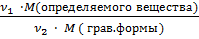
Массовая доля (w, %) определяемого вещества рассчитывается по формуле:
ω = mграв.ф.· F ·  , где mнав. -масса навески анализируемого образца
, где mнав. -масса навески анализируемого образца
Если навеска образца растворяется в колбе вместимостью Vк, то на одно определение берется пипеткой аликвота раствора Vп, то:
W = mграв.ф. · F ·  ·
· 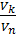
1) Рассчитать гравиметрический фактор в следующих определениях
| Вариант | а | б | в |
| Определяемое вещество | Bi | Mg | К3РО4 |
| Гравиметрическая форма | Bi2О3 | Mg2Р2О7 | К2РtCl6 |
Решение
а)F =  ;б)F =
;б)F =  ; в)F =
; в)F =  ;
;
2) Определить массовую долю магния в сплаве с алюминием, исходя из таких данных: навеска сплава 2,0270 г; состав весовой формы-Mg2P2O7, масса весовой формы – 0,2855 г;
Решение:
ω(Mg) = mграв.ф·F ·  = m(Mg2P2O7) · F ·
= m(Mg2P2O7) · F ·  ;
;
F =  =
=  = 0,2162
= 0,2162
ω(Mg) = 0, 2855 · 0,2162 ·  = 3,045 %
= 3,045 %
Ответ: 3,045%
3) Навеску алюминиевого сплава массой 0,1425 г растворили в колбе вместимостью 200,0 мл. Из 20,00 мл этого раствора получили осадок Al(C9H6ON)3 массой 0,2012 г. Рассчитать массовую долю алюминия в сплаве.
Решение
ω(Al) = mграв.ф.· F ·  ·
·  ; F =
; F =  =
= 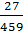 = 0,0588
= 0,0588
ω(Al) = 0,2012 · 0,0588 ·  ·
·  = 82,91 %
= 82,91 %
Ответ: 82,91%
3. Выполнение контрольного задания
Вариант 1
1) Рассчитать гравиметрический фактор, если определяемое вещество - Аl, а гравиметрическая форма –Al2O3.
2) Определить массовую долю серы в природном гипсе, исходя из таких данных: навека гипса 0,5025 г; состав весовой формы -BaSO4, масса весовой формы – 0,6375 г.
3) Навеску криолита массой 0,4525 г растворили в колбе вместимостью 250 мл. Из 25,00 мл этого раствора получили осадок Al2O3 массой 0,0809 г. Рассчитать массовую долю алюминия в криолите.
Вариант 2
1) Рассчитать гравиметрический фактор, если определяемое вещество –
Na2 S2O3, а гравиметрическая форма – BaSO4.
2) Определить массовую долю алюминия в боксите, если для анализа взяли навеску 0,3115 г; состав весовой формы - Al2O3, масса весовой формы – 0,2213 г.
3) Навеску сплава массой 0,2100 г растворили в колбе вместимостью 250 мл. Из 25,00 мл этого раствора получили осадок Cо3O4 массой 0,1012 г. Определить массовую долю кобальта в сплаве.
Практическая работа
ВЫЧИСЛЕНИЯ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
Цель: научиться проводить расчеты при определениях методами титриметрического анализа
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1. Основные теоретические положения
а) СН изготовленного раствора = 
б) Согласно закону эквивалентов, в точке эквивалентности число эквивалентов одного вещества равно числу эквивалентов другого вещества. Поэтому объемы реагирующих растворов, обратно пропорциональны их нормальностям:  =
= 
1) Вычислить навеску для изготовления 250 мл 0,1 Н раствора буры.
Решение
𝒎навески = СН · 𝒎э · V · 0,001
Vраств = 250 мл Ε (Na2 B4O7 · 10H2O) =  моль
моль
СН =0,1 моль/л me (Na2B4O7 · 10H2O) =  =
=  = 190,5г
= 190,5г
𝒎 навески -? mнавески = 0,1 моль/л · 190,5г · 250мл ·0,001 =
= 4,7625 г
Ответ: 4,7625 г
2)Определить нормальность раствора соляной кислоты, если на титрование 25 мл 0,1082 Н раствора буры истрачено 24,72 мл раствора соляной кислоты
Решение:
V(HCl) = 24,72 мл Согласно закону эквивалентов:
V(буры) = 25мл  =
= 
CH(буры) = 0.1082моль/л тому
CH (HCl) -? СН(HCl) = 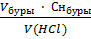
CH(HCl) =  = 0,1094 моль/л
= 0,1094 моль/л
Ответ:0,1094 Н.
3)Определить нормальность раствора гидроксида натрия, если на титрование 25 мл 0,1094 Н раствора соляной кислоты истрачено 28,75 мл раствора гидроксида натрия.
Решение:
V(HCl) = 25мл По закону эквивалентов
CH(HCl) = 0.1094 моль / л  =
=  поэтому
поэтому
V(NaOH) = 28.75мл Сн(NaOH) =  =
=  =
=
CH(NaOH) -? = 0.0951 моль / л
Ответ: 0,0951 моль/л
3.Выполнение контрольного задания.
Вариант 1.
1) Вычислить навеску для изготовления 250 мл 0,1Н раствора питьевой соды (NaHCO3)
2) Вычислить нормальность раствора гидроксида натрия, если на титрование 25 мл 0,1235Н раствора щавелевой кислоты истрачено 26,55 мл гидроксида натрия.
Вариант 2.
1) Вычислить навеску для приготовления 250 мл 0,1Н раствора щавелевой кислоты (H2C2O4 · 2H2O)
2) Определить нормальность раствора соды (NaHCO3), если на титрование 25 мл раствора соды истрачено 22,45 мл 0,1155Н раствора соляной кислоты.
Практическая работа
ПОСТРОЕНИЕ КРИВЫХ ТИТРОВАНИЯ
Цель: научиться строить кривые титрования и выбирать индикаторы
Оборудование: инструкции к практической работе, карандаш, линейка
Ход работы
1. Основные теоретические положения
Для того, чтобы правильно выбрать индикатор, необходимо знать, как изменяется рН в процессе титрования вблизи точки эквивалентности, какое значение рН имеет раствор в точке эквивалентности. Чтобы ответить на эти вопросы, рассчитывают и строят кривые титрования.
Кривые титрования в методе нейтрализации – это графическое изображение изменения рН раствора при постепенном добавлении рабочего раствора к определенному количеству исследуемого раствора.
Кривая титрования характеризуется резким изменением рН вблизи точки эквивалентности, которое называют скачком титрования. Чем больше скачок, тем точнее возможно оттитровать определяемое вещество. Наличие скачка рН вблизи точки эквивалентности имеет большое значение при выборе индикатора. Для установления конечной точки титрования применяют индикаторы, которые изменяют окраску в определенном интервале рН.
Если бы скачок титрования отсутствовал, то окрашивание раствора изменялось бы медленно, и было бы неизвестно, в какой момент завершить титрование, то есть точное титрование было бы невозможно.
Основное правило выбора индикатора: для каждого данного титрования возможно использовать лишь такие индикаторы, которые изменяют окрашивание в границах скачка на кривой титрования, то есть интервал перехода индикатора должен быть расположен в границах скачка рН на кривой титрования.
Вывод: для установления точки эквивалентности при титровании 100 мл 0,1 М раствора HCl 0,1М раствором NaOH в качестве индикаторов возможно использовать фенолфталеин и метиловый оранжевый, потому что их интервал перехода лежит в границах скачка на кривой титрования.
Построить кривую титрования 100 мл 0,1 М раствора HCl 0,1М раствором NaOH (сильной кислоты раствором щелочи).
Решение
Рассчитаем величину рН в разные моменты титрования:
а) Начальный момент титрования: в растворе присутствует HCl 0,1М концентрации
б) Любой момент титрования до точки эквивалентности:
- к 100 мл 0,1м раствора добавлено 90 мл раствора NaOH, то в данный момент титрования не нейтрализовано 10 мл 0,1М HCl, которые находятся в общем объеме 100 мл, то есть концентрация HCl уменьшилась в 10 раз и составила 0,01М; рН=2
- аналогично можно рассчитать, что, когда добавлено 99 мл 0,1М NaOH, рН=3; когда добавлено 99,9 мл 0,1М NaOH, рН=4
в) в момент эквивалентности к 100 мл HCl добавлено 100 мл NaOH; в этот момент раствор содержит только соль NaCl, не подвергающуюся гидролизу, рН=7
г) после точки эквивалентности:
- к 100 мл 0,1М раствора HCl добавлено 100,1 мл 0,1М раствора NaOH; избыточное количество раствора NaOH составляет0,1 мл, что создает концентрацию ОН- в этот момент титрования 10-4 моль/л, рН=10
- аналогично можно рассчитать, что при добавлении 101 мл 0,1М раствора NaOH рН=11, 110 мл 0,1М NaOH: рН=12; 200 мл: рН=13
Полученные результаты представлены в таблице 1 и на рисунке 1.
Таблица 1
| Добавлено NaOH, мл | С HCl, моль/ л | С NaOH, моль/л | [ H+ ] | [ OH ] | pH |
| 0 | 0,1 | - | 10-1 | 10-13 | 1 |
| 90 | 0,01 | - | 10-2 | 10-12 | 2 |
| 99 | 0,001 | - | 10-3 | 10-11 | 3 |
| 99,9 | 0,0001 | - | 10-4 | 10-10 | 4 |
| 100 | - | - | 10-7 | 10-7 | 7 |
| 100,1 | - | 0,0001 | 10-10 | 10-4 | 10 |
| 101,0 | - | 0,001 | 10-11 | 10-3 | 11 |
| 110 | - | 0,01 | 10-12 | 10-2 | 12 |
| 200 | - | 0,1 | 10-13 | 10-1 | 13 |
Рис. 1. Кривая титрования 0,1М раствора HCl 0,1М раствором NaOH
Практическая работа
ВЫЧИСЛЕНИЯ МЕТОДА НЕЙТРАЛИЗАЦИИ
Цель: научиться проводить расчеты при определениях методом нейтрализации
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1) Рассчитать нормальность и титр раствора HCl, если на титрование 2,0 мл исследуемого раствора истрачено 3,0 мл 0,02 Н раствора NaOH.
Решение
V(NaOH) = 3,0 мл По закону эквивалентов:
Сн(NaOH) = 0,02моль/л 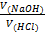 =
=  , поэтому
, поэтому
V(HCl) = 2,0 мл Сн(HCl) =  =
=
Сн(HCl) -? =  = 0,03 моль/л
= 0,03 моль/л
T(HCl) -? T =  або T = Сн · mэ
або T = Сн · mэ
mэ(HCl) = M · Э =36,5 г/моль ·  моль = 36,5 г
моль = 36,5 г
Т = 0,03 · 36,5 = 1,095 г/л
Ответ: 0,03 Н; 1,095г/л
2) Определить массу буры (Na2B4O7·10H2O), если на титрование ее раствора истрачено 15,1 мл соляной кислоты с концентрацией 0,103М
Решение
V(HCl) = 15,1мл В титриметрическом анализе концентрацию титран-
Сн(HCl) = 0,103моль/л та соляной кислоты устанавливают по буре:
m(Na2B4O7 · 10H2O) -? Na2B4O7 + 2HCl + 5H2O → 2NaCl + 4H3BO3
По закону эквивалентов:
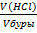 =
=  , то есть V(HCl) · Сн(HCl) = Сн(буры) · Сн(буры)
, то есть V(HCl) · Сн(HCl) = Сн(буры) · Сн(буры)
Сн =  , поэтому V(HCl) · Сн(HCl) =
, поэтому V(HCl) · Сн(HCl) =  · V(буры) = nэкв.(буры) =
· V(буры) = nэкв.(буры) =
=  .
.
mэ(буры) = M · Э; Э(Na2B4O7 · 10H2O) =  моль
моль
M(Na2B4O7 · 10H2O) = 382г/моль
mэ(буры) = 382 ·  = 191г
= 191г
Сн(HCl) = См(HCl) = 0,103моль/л, потому что Э(HCl) =  моль
моль
m(буры) = V(HCl) · Сн(HCl) · mэ(буры) = 15,1 · 10-3 · 0,103 · 191 = 0,297 г
Ответ: 0,297 г.
3) Проба муравьиной кислоты массой 2,32 г розбавлена водой в мерной колбе вместимостью 100 мл. На титрование 10,0 мл разбавленного раствора страчено 7,2 мл титр анта с концентрацией КOH 0,150 М. Рассчитать массовую долю муравьиной кислоты в исходном растворе.
Решение
m проби(HCOOH) = 2.32г По закону эквивалентов
VK = 100 мл 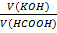 =
= 
Vn = 10,0мл Сн(HCOOH) = См(KOH),
V(KOH) = 7,2мл Э(KOH) =  моль
моль
CM(KOH) = 0,150моль/л Сн(HCOOH) =  =
=  =
=
w(HCOOH) -? =  = 0,108 моль/л
= 0,108 моль/л
Сн(НСООН) = См(НСООН), потому что
Э(НСООН) =  моль; См(НСООН) =
моль; См(НСООН) = 
n(HCOOH) = См(HCOOH) · VK; n =  , поэтому
, поэтому  = См · VK;
= См · VK;
m(HCOOH) = CM · VK · M(HCOOH); m(HCOOH) = 0,108 · 100 · 10-3 · 46 = 0,4968г
W(HCOOH) =  · 100%
· 100%
W(HCOOH) =  · 100% = 21,41%
· 100% = 21,41%
Ответ: 21,41%
II. Выполнение контрольного задания
Вариант 1.
1) Рассчитайте нормальность и титр раствора HCl, если на титрование 3,0 мл исследуемого раствора истрачено 4,5 мл 0,15Н раствора NaOH
2) Рассчитайте массу уксусной кислоты в исследуемом растворе, если на титрование пробы этого раствора было истрачено 20,5 мл раствора с молярной концентрацией NaOH 0,1145 моль/л
3) Навеску H2C2O4 · 2H2O массой 0,6 г растворили в мерной колбе вместимостью 100 мл. На титрование 20,00мл полученного раствора истратили 18,34 мл NaOH с концентрацией NaOH 0,1038М. Рассчитать массовую долю щавелевой кислоты в растворе.
Вариант 2.
1) Рассчитайте нормальность и титр раствора HCl, если на титрование 5,0 мл исследуемого раствора истрачено 9,5 мл 0,25Н раствора NaOH
2) Рассчитайте массу ортофосфорной кислоты в исследуемом растворе, если на титрование пробы этого раствора было истрачено 22,5 мл раствора с молярной концентрацией NaOH 0,1235 моль/л
3) Навеску NaOH массой 0,5341 г растворили в мерной колбе вместимостью 100 мл. На титрование 15,00мл полученного раствора истратили 19,5 мл раствора HCl с концентрацией 0,0945М. Рассчитать массовую долю NaOH в исходном растворе.
Практическая работа
ВЫЧИСЛЕНИЯ МЕТОДА ПЕРМАНГАНАТОМЕТРИИ
Цель: научиться проводить расчеты при определениях методом перманганатометрии
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
1) Молярная концентрация окислителя в растворе равна 0,02 моль/л. Определите молярную концентрацию эквивалента окислителя, учитывая химизм:
KMnO4 + H2O2 + H2SO4 → MnSO4 + ………
Решение
+7 -1
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2О
Mn+7 + 5ē → Mn+2 5 2
1
2O-2 – 2ē → O20 2 5
KMnO4–окислитель; Э(KMnO4) =  моль
моль
Сн = См ·  ; Сн(KMnO4) = 0,02 · 5 = 0,1 моль/л
; Сн(KMnO4) = 0,02 · 5 = 0,1 моль/л
Ответ: 0,1 Н.
2) Навеску H2O2 растворили в мерной колбе вместимостью 100 мл. На титрование 10 мл полученного раствора стратили 9,8 мл 0,02М раствора KMnO4 в сильно кислой среде. Определите массу навески.
Решение
VK = 100мл
Vn = 10мл При перманганатометричному титруванні
V(KMnO4) = 9,8мл пероксиду водню перебігає реакція:
CM(KMnO4) = 0,02моль/л 5H2O2 + 2KMnO4 + 3H2SO4→5O2 + 2MnSO4 +
m(H2O2) -? + K2SO4 + 8H2O
Mn+7 + 5ē → Mn+2 5 2
1
2O-1 - 2ē → O20 2 5
Э(H2O2) =  моль; Э(KMnO4) =
моль; Э(KMnO4) =  моль
моль
Маса навески H2O2 определяется по формуле:
m н(H2O2)= V(KMnO4) · CH(KMnO4) · mэ(H2O2) ·  ;
;
CH(KMnO4) = CМ(KMnO4) ·  = Cм(KMnO4) · 5 = 0,02 · 5 = 0,1моль/л
= Cм(KMnO4) · 5 = 0,02 · 5 = 0,1моль/л
mэ(H2O2) = M(H2O2) · Э = 34 ·  = 17г
= 17г
m н(H2O2)= 9.8 · 10-3· 0.1 · 17 ·  = 0,167г
= 0,167г
Ответ: 0,167 г.
II. Выполнение контрольного задания
Вариант 1
1) Молярная концентрация окислителя в растворе составляет 0,15 моль/л. Определите молярную концентрацию эквивалента окислителя, учитывая химизм:
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
2) Навеску H2O2 растворили в мерной колбе вместимостью 100 мл. На титрование 10 мл полученного раствора истратили 14,50 мл 0,04М раствора KMnO4 в сильно кислой среде. Определите массу навески.
Вариант 2
1) Молярная концентрация окислителя в растворе составляет 0,04 моль/л. Определите молярную концентрацию эквивалента окислителя, учитывая химизм:
5HAsO2 + 2KMnO4 + 3H2SO4 + 2H2O → 5H3AsO4 + 2MnSO4 + K2SO4
2) Навеску H2O2 растворили в мерной колбе вместимостью 100 мл. На титрование 10 мл полученного раствора истратили 14,50 мл 0,15М раствора KMnO4 в сильно кислой среде. Определите массу навески.
Практическая работа
ВЫЧИСЛЕНИЯ МЕТОДА ИОДОМЕТРИИ
Цель: научиться проводить расчеты при определениях методом иодометрии
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
I. Решение типовых задач
1) Рассчитать молярную массу эквивалента свинца при его иодометрическом определении по схеме:
Pb2+ + CrO42-→ PbCrO4(т) (1)
2PbCrO4(т) +2H+ → 2Pb2+ +CrO72- + H2O(2)
Cr2O72- + 6I- + 14H+ → 3I2 + 2Cr3+ + 7H2O (3)
I2 + 2S2O32- → 2I- + S4O62- (4)
Решение:
Реакции (1) и (2) не когут бать использованы для определения молярной массы эквивалента свинца, так как ни свинец, ни хром не изменяют степени окисления, то есть эти процессы взаимодействия частиц не сопровождаются передачей электронов. По реакции (3):
Cr2O72- + 6I- + 14H+ → 3I2+ 2Cr3+ + 7H2O
Cr2O72- + 14H+ + 6ē→ 2Cr3+ + 7H2O
Поэтому Э(Cr2O72-) =  моль. С учетом коэффициентов в уравнениях
моль. С учетом коэффициентов в уравнениях
2PbCrO4 (т) + 2H+→2Pb2+ + Cr2O72- +H2O (2)
Pb2+ + CrO42- →PbCrO4(т) (1)
Э(Pb2+) =  моль
моль
mэ = M ·Э; поэтому mэ(Pb2+) = 207 ·  = 69г
= 69г
Ответ: 69 г.
2) Определить массу эквивалента окислителя и восстановителя в реакциях:
а) I2 + 2S2O32- → 2I- + S4O62-
б) H2S + I2→ S(m) + 2I- +2H+
Решение:
а)I2 + 2S2O32-→2I- + S4O62-
окислитель I20 + 2e → 2I- 1
восстановитель 2S2O32- - 2e →S4O62- 1
Э(I2) =  моль; mэ(I2) = 254 ·
моль; mэ(I2) = 254 ·  = 127 г
= 127 г
Э(S2O32-) =  моль; mэ(S2O32-) = 112 г.
моль; mэ(S2O32-) = 112 г.
Ответ: 127 г и 112 г.
б) H2S + I2→ S(m) + 2I- + 2H+
восстановитель S2- - 2e → S0 1
окислитель I20 + 2e → 2I- 1
Э(S2-) =  моль; mэ(H2S) = 34 ·
моль; mэ(H2S) = 34 ·  = 17 г
= 17 г
Э(I2) =  моль; mэ(I2) = 254 ·
моль; mэ(I2) = 254 ·  = 127 г
= 127 г
Ответ: 127 г и 17 г.
3) Рассчитать массовую долю меди в природной руде, если из навески руды массой 0,6215 г медь перевели в раствор в виде Cu2+ и при добавлении к этому раствору КІ, иод, который выделился, оттитрорвали 18,23 мл раствора тиосульфата натрия с Т (Na2S2O3) = 0,01545г/мл
mH = 0,6215 г Решение:
V(Na2S2O3) = 18,23мл Сущность иодометрического определения
T(Na2S2O3) = 0,01545 г/мл описывается следующими реакциями:
2Cu2+ + 4I- →I2 + Cu2I2 ↓
W(Cu) -? I2 + 2S2O32- → 2I- + S4O62-
Cu2I2 + 2SCN-→ 2I- + S4O62-
Формула для расчета имеет вид:
W(Cu) =  · mэ(Cu) ·
· mэ(Cu) ·  ;
;
Cu2+ + 1ē → Cu+1, поэтому
Э(Cu 2+) =  моль; mэ(Cu2+) = 63,5г
моль; mэ(Cu2+) = 63,5г
2S2O32-- 2ē→ S4O62-, поэтому
Э(S2O32-) =  моль
моль
mэ(Na2S2O3) = 158 г
W(Cu) =  · 63,5 ·
· 63,5 ·  = 18,22%
= 18,22%
Ответ: 18,22 %.
4) Навеску K2Cr2O7 массой 0,2940 г растворили в мерной колбе вместимостью 100,0 мл. На 25,00 мл полученного раствора подействовали раствором KI. На титрование выделившегося иода истратили 20,00 мл раствора Na2S2O3. Рассчитать T(Na2S2O3).
mн= 0,2940г Решение:
VK = 100,00мл Запишем уравнения химических реакций,
Vn = 25,00мл которые отображают сущность метода:
V(Na2S2O3) = 20,00мл Cr2O72- + 6I- + 14H+→ 3I2 + 2Cr3+ + 7H2O
I2 + 2S2O32-→ 2I2 + S4O2- (3)
T(Na2S2O3) -? Э(Cr2O72-) =  моль
моль
mэ(K2Cr2O7) = 294 ·  = 49 г
= 49 г
Э(S2O32-) =  моль
моль
mэ(Na2S2O3) = 158 г
По закону эквивалентов:
T(Na2S2O3)=  =
=
=  = 0,01185 г/мл
= 0,01185 г/мл
Ответ: 0,01185 г/мл
II. Выполнение контрольного задания
Вариант 1
1)Определить эквивалентную массу окислителя и восстановителя в реакции:
H2SO3 + I2 + H2O→ SO42- + 2I- + 4H+
3) Рассчитать массовую долю меди в природной руде, если из навески руды массой 0,6125 г медь перевели в раствор в виде Cu2+ и при добавлении к этому раствору KI выделившийся иод оттитровали 19,25 мл раствора тиосульфата натрия с T(Na2S2O3) = 0,01435 г/мл.
Вариант 2
1) Определить эквивалентную массу окислителя и восстановителя в реакции:
MnO2(m) + 2I- + 4H+ → Mn2+ + I2 + 2H2O
2) Навеску K2Cr2O7 массой 0,1939 г растворили в мерной колбе вместимостью 200,00 мл. На 25,00 мл полученного раствора подействовали раствором KI. На титрование выделившегося иода истратили 25,00 мл раствора Na2S2O3. Рассчитать титр Na2S2O3.
Практическая работа
ВЫЧИСЛЕНИЯ МЕТОДА ОСАЖДЕНИЯ
Цель: научиться проводить расчеты при определениях методом осаждения
Оборудование: инструкции к практической работе, периодическая система Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде
Ход работы
I. Решение типовых задач
1) Какая масса соли, формула которой указана в таблице, необходима для изготовления V(мл) растора с молярной концентрацией эквивалента, указанной в таблице:
| Вариант | Формула соли | V,мл | Сн, моль/л |
| а) | KCl | 250 | 0.05 |
| б) | Hg2(NO3)2 · 2H2O | 500 | 0.05 |
а) CH = 0,05моль/л Решение:
Vр-ра = 250мл Сн = См ·Э;Э(KCl) =  моль, поэтому
моль, поэтому
m(KCl) -? Сн = См = 0,05 моль/л
См =  ; n = См · V;
; n = См · V;
n(KCl) = 0,05моль/л· 0,25л = 0,0125 моль
m(KCl) = n · M = 0,0125моль· 74,5г/моль = 0,93 г
Ответ: 0,93 г.
б)Сн = 0,05 моль/л Розв’язок:
Vр-ра = 500мл Сн = См ·Э; Э(Hg2(NO3)2) =  моль
моль
m(Hg2(NO3)2 ·2H2O) -? См =  = 0,05моль/л · 2 = 0,1моль/л
= 0,05моль/л · 2 = 0,1моль/л
n= См · V;
n(Hg2(NO3)2) = 0,1моль/л · 0,5л = 0,05 моль
m(Hg2 (NO3)2 · 2H2O) = n ·M =
=0,05моль· (201 · 2 + 14 · 2 + 16 · 6 + 2 · 18)г/моль = 0,05 моль · 564 г/моль = =28,2 г
Ответ: 28,2 г
2) Чему равна молярная маса эквивалента K4[Fe(CN)6] при тировании Zn2+ по реакции
3Zn2+ + 2K+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]2↓
Решение:
E(Zn2+) =  моль. Если разделить обе части уравнения на 6
моль. Если разделить обе части уравнения на 6
 Zn2+ +
Zn2+ +  [Fe(CN)6]4-→
[Fe(CN)6]4-→  K2Zn3[Fe(CN)6]2↓, то очевидно, что с эквивалентом цинка (
K2Zn3[Fe(CN)6]2↓, то очевидно, что с эквивалентом цинка ( моль) взаимодействует
моль) взаимодействует  моль[Fe(CN)6]4-. Из этого следует, что Э(K4[Fe(CN)6] =
моль[Fe(CN)6]4-. Из этого следует, что Э(K4[Fe(CN)6] =  моль.
моль.
mэ = M · Э, потому mэ(K4[Fe(CN)6]) = 368 ·  = 122,78г
= 122,78г
Отве
 2020-04-12
2020-04-12 2854
2854






