Лекция№7. ОХТ. Производство органических веществ
Производство органических веществ.
В настоящее время наибольшее применение в экономике имеют такие продукты органического синтеза, как метиловый эфир, ацетон, уксусная кислота, фенол, анилин, фталевый ангидрид, бутадиен, стирол, хлорированные углеводороды и др.
Сырьем для получения служат водород, окись углерода, метан и его гомологи, этилен, пропилен, н -бутилен, изобутилен и др., получаемые при переработке жидкого, твердого и газообразного топлива. В производстве синтетических органических веществ используются процессы окисления, гидратации и дегидратации, сульфирования, нитрования, галогенирования и др.
В качестве примера рассмотрим синтез органических продуктов на основе окиси углерода и непредельных углеводородов.
Синтез на основе окиси углерода.
Органический синтез на основе окиси углерода широко применяется в промышленности. Из окиси углерода получают алифатические углеводороды, спирты, альдегиды, карбоновые кислоты и их производные.
Метиловый спирт CH3OH – токсичная жидкость, плотностью 796 кг/м3, которая смешивается с водой в любых соотношениях температура кипения 64,7°С.
Метиловый спирт в настоящее время в основном получают из оксида углерода (II) и водорода при температуре 230-420°С и давлении 20-32 МПа.
Физико-химические основы процесса. Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
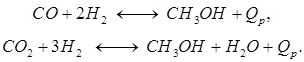
Обе реакции экзотермичны и протекают с уменьшением объема. Из этого следует, что для достижения максимальных значений выхода метанола и степени превращения синтез-газа необходимо проведение процесса при низких температурах и высоких давлениях.
Максимально достижимая степень превращения синтез-газа при этом ограничена условиями равновесия реакций получения метанола, которые изучены экспериментально и теоретически. Для расчета константы равновесия реакции 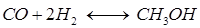 получено уравнение
получено уравнение
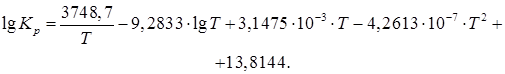
| (6.19) |
Константу равновесия реакции 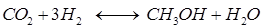 можно рассчитать, исходя из значений константы равновесия первой реакции, а также используя константу равновесия реакции, которая сопровождает образование метанола:
можно рассчитать, исходя из значений константы равновесия первой реакции, а также используя константу равновесия реакции, которая сопровождает образование метанола:
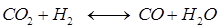 .
.
При этом 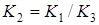 . Такой метод расчета констант равновесия в данном случае применим, так как второе уравнение можно получить, вычтя из первого уравнения третье уравнение. При этом, выбирая оптимальный температурный режим, следует учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров:
. Такой метод расчета констант равновесия в данном случае применим, так как второе уравнение можно получить, вычтя из первого уравнения третье уравнение. При этом, выбирая оптимальный температурный режим, следует учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров:
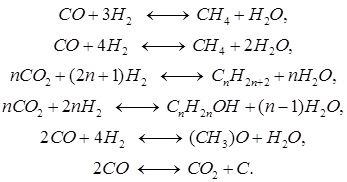
Для ускорения целевой реакции – получения метанола на практике применяют твердые катализаторы: цинк-хромовые или медьсодержащие катализаторы. Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие – необратимо.
Для описания скорости синтеза метанола на цинк-хромовом катализаторе (процесс изучался во взвешенном слое и лимитирующей стадией принималась адсорбция водорода) может быть описана уравнением:
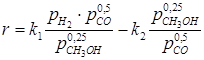 , ,
| (6.20) |
где k1 и k2 – константы скорости прямой и обратной реакции; р - парциальное давление.
Для расчета скорости на медь-цинк-алюминиевом катализаторе применимо уравнение:
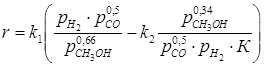 , ,
| (6.21) |
где k1 – константы скорости прямой реакции; К – константа равновесия.
Константа скорости k1 в уравнении (5.21) может быть рассчитана по формуле:
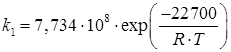 . .
| (6.22) |
Интервал оптимальных температур, соответствующих наибольшему выходу продукта, определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Процессы низкого давления (5-10 МПа) на медьсодержащих катализаторах осуществляют при температурах 220-280°С. Для цинк-хромового катализатора характерны более высокие давления (20-30 МПа) и температуры (350-400°С).
Влияние давления на синтез метанола иллюстрируется рис. 6.19.
Максимальное давление, применяемое в промышленных синтезах, составляет 40 МПа; выше этого давления ускоряются побочные реакции и, кроме того, увеличение затрат на компрессию газа ухудшает экономические показатели процесса. В синтезах низкого давления повышение давления ограничено термической стабильностью медных катализаторов.
С возрастанием объемной скорости газа выход метанола падает. Это справедливо для синтеза как при высоком, так и при низком давлении. Такая закономерность основана на том, что с увеличением объемной скорости уменьшается время контакта газа с катализатором и, следовательно, концентрация метанола в газе, выходящем из реактора.
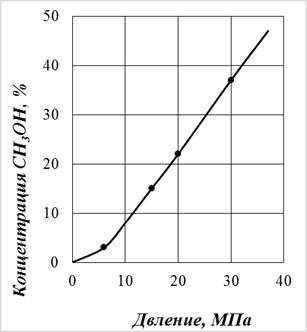 Рис. 6.19. Зависимость выхода метанола от давления при 350°С и молярном соотношении H2:CO = 2:1
Рис. 6.19. Зависимость выхода метанола от давления при 350°С и молярном соотношении H2:CO = 2:1
| 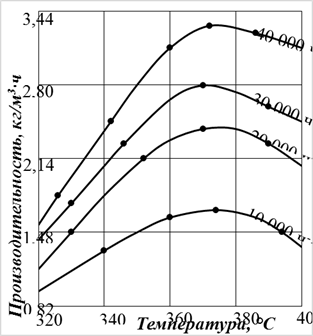 Рис. 6.20. Зависимость производительности катализатора при 30 МПа от объемной скорости
Рис. 6.20. Зависимость производительности катализатора при 30 МПа от объемной скорости
|
На рис. 6.20 показана зависимость производительности катализатора при 30 МПа от объемной скорости. С увеличением объемной скорости подачи сырья содержание метанола в газе снижается, однако за счет большего объема газа, проходящего в единицу времени через тот же объем катализатора, производительность последнего увеличивается. На практике процесс синтеза осуществляют при объемных скоростях 20 000 – 40 000 ч-1.
Степень превращения синтез-газа в метанол (а, следовательно, и его выход) за один проход через реактор ограничена положением равновесия реакции  и допустимым перепадом температуры по слою катализатора при адиабатическом режиме процесса. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержатся только ~4% СН3ОН. С целью возможно более полной переработки синтез-газа его необходимо возвращать в рецикл после выделения метанола и воды. Однако при циркуляции синтез-газа накапливаются инертные примеси (СН4, N2, Ar) и их концентрацию регулируют частичной отдувкой газа.
и допустимым перепадом температуры по слою катализатора при адиабатическом режиме процесса. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержатся только ~4% СН3ОН. С целью возможно более полной переработки синтез-газа его необходимо возвращать в рецикл после выделения метанола и воды. Однако при циркуляции синтез-газа накапливаются инертные примеси (СН4, N2, Ar) и их концентрацию регулируют частичной отдувкой газа.
 2020-04-12
2020-04-12 609
609







