Для составления ОВР нужно определить степени окисления элементов, воспользуйтесь правилами:
1. У простых веществ (О2, Н2, N2, С, Mg и др.) степень окисления всегда равна нулю.
2. У водорода Н в сложных веществах всегда +1, кроме гидридов МеН (КН, NaH, CaH2).
3. У кислорода О в сложных веществах всегда -2, кроме пероксидов Na2O2, H2O2 (с. о. кислорода -1)и фторида кислорода OF2 (с. о. кислорода +2)
4. В основаниях МеОН и в солях Ме Кисл. Степень окисления смотрим в таблице растворимости в конце учебника. Степень окисления: записываем сначала знак, а потом цифру!!! Например, +2, -3.
5. Остальные элементы расчитываем, исходя из принципа, что сумма степеней должна быть равна 0.
Пример 1: расставьте степени окисления в соединении 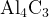 .
.
Мы знаем степень окисления 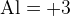 тогда мы можем найти, что общее количество
тогда мы можем найти, что общее количество
«плюсов» у четырех атомов 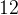 . Чтобы в сумме был ноль, у трех атомов
. Чтобы в сумме был ноль, у трех атомов 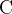 заряд
заряд
должен быть 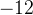 , значит у каждого атома
, значит у каждого атома 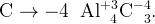
Пример: Найдите степени окисления всех атомов в соединении 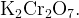
Сначала подпишем постоянные степени окисления 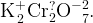
Посчитаем общее количество плюсов и минусов 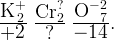
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов
в сумме должно быть 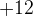 , а значит, у каждого атома
, а значит, у каждого атома 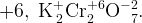
Пример: Найдите степени окисления всех атомов в соединении 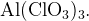
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как 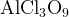 и тогда задание выполняется аналогично заданию из примера 2.
и тогда задание выполняется аналогично заданию из примера 2.
Ответ: 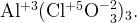
В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
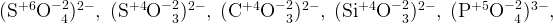

Простые вещества, если они записаны с индексом 2 (сзади), выписываете как в уравнении.
Слева эту двойку выставляете впереди, невзирая на цифры, которые стоят в уравнении.
(слева 2 и справа должно быть 2!)
Ещё два примера посложнее:
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
1. Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:
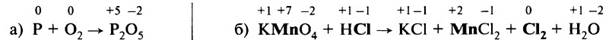
2. Составим схемы, отражающие процессы перехода электронов:

3. Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:
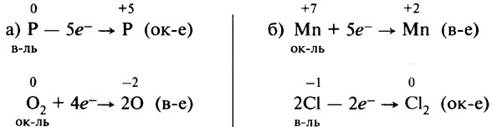
4. Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:
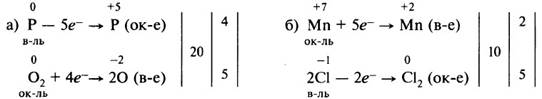
5. Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:
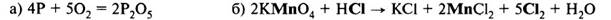
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl– участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
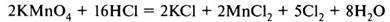
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).
 2020-05-12
2020-05-12 152
152






