Введение
Материаловедение – наука о связях между составом, строением и свойствами материалов и закономерностях их изменений при внешних физико-механических воздействиях. От правильного выбора материала зависит долговечность, надежность и срок службы изделий. Необходимые механические и технологические свойства материалов достигаются термической обработкой, выбор которой зависит от материала и его дальнейшей эксплуатации. Проектирование конкурентоспособных изделий, организация их производства невозможны без достаточного уровня знаний в области материаловедения.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики, которые могут работать как при высоких температурах, так и при температурах, близких к абсолютному нулю. Современные компьютерные технологии используют материалы с особыми электрическими свойствами.
Задачи материаловедения в настоящее время связаны с производством металлов и сплавов, а также других материалов с заранее заданными свойствами. Решение таких задач достигается теоретическим знанием структуры и свойств материалов и умением приложить их к практическому применению.
Рассмотрено строение, свойства и области применения металлов и металлических сплавов, композиционных материалов и наноматериалов для получения заготовок и деталей высокого качества.
При изучении дисциплины решаются задачи приобретения знаний оценки технических свойств материалов, исходя из условий эксплуатации и изготовления изделий; формирования научно-обоснованных представлений о возможностях рационального изменения технических свойств материала путем изменения его структуры; о ознакомления со способами упрочнения материалов, обеспечивающими надежность изделий и инструментов.
СТРОЕНИЕ МЕТАЛЛОВ
Металлы, особенности атомно-кристаллического строения
Материаловедение – это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами. Все материалы по химической основе делятся на две основные группы – металлические и неметаллические. В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого – в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов. Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чего является высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создавая электрический ток. Недостроенность валентных энергетических зон металлов определяет их высокую электропроводность, теплопроводность, металлический блеск и др. Все металлы имеют положительный температурный коэффициент электрического сопротивления. Отсутствие сильных направленных связей между атомами, характерных для ионного и ковалентного типов связи, определяет пластичность металлов.
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы со значением температуры плавления выше 1800 °С называют тугоплавкими. К ним принадлежат Ti, Zr, Cr, V, Nb, Mo, W и др. Металлы с низким значением температуры плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относятся металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Аu, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны. К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды (Се, Pr, Nd и др.) и сходные с ними Y и Sc.
Группу урановых металлов составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
К группе щелочно-земельных металлов относят Li, Na, К и др. Их используют в качестве теплоносителей в ядерных реакторах.
Ряд металлов (Fe, Ni, Co, Gd) в связи с особенностями их электронного строения обладает ферромагнетизмом – способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен – это область кристалла размером 10‾4–10‾6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Свойства металлов разнообразны. Ртуть замерзает при температуре – 38,8 °С; вольфрам выдерживает рабочую температуру до 2000 °С; литий, калий, натрий легче воды; иридий и осмий в 42 раза тяжелее лития. Вместе с тем металлы имеют общие характерные свойства: высокую пластичность, высокие тепло- и электропроводность, положительный температурный коэффициент электрического сопротивления, хорошую отражательную способность, термоэлектронную эмиссию (способность к испусканию электронов при нагреве), кристаллическое строение.
| Рис. 1.1. Схема кристаллической решетки |
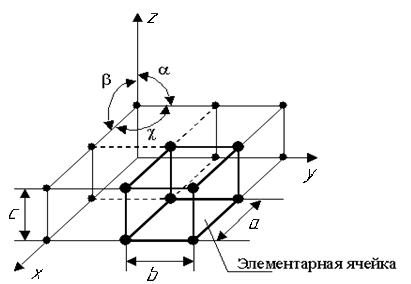 Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, т.е. укладка атомов в них характеризуется закономерным расположением в пространстве, т.е. порядком – периодичностью как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка (рис. 1.1).
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, т.е. укладка атомов в них характеризуется закономерным расположением в пространстве, т.е. порядком – периодичностью как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка (рис. 1.1).
Кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Она характеризует особенности строения кристалла.
Основными параметрами кристалла являются:
– размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. Период решетки выражается в нанометрах (1 нм = 10–9 м). Пери-оды решетки для большинства металлов находятся в пределах 0,3 – 0,7 нм, размеры элементарных ячеек 0,2 – 50,3 нм;
– углы между осями (α, β, χ);
– координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
– базис решетки, число атомов, приходящихся на одну элементарную ячейку решетки;
– плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами, к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве.
Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
– примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
– базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
– объемно-центрированный – атомы занимают вершины ячеек и ее центр;
– гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Наиболее часто металлы имеют кристаллические решетки следующих типов:
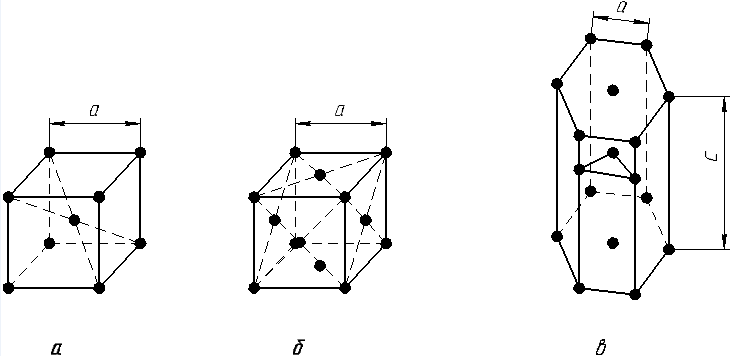
1. Объемно-центрированная кубическая (ОЦК) (рис. 1.2, а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα).
2. Гранецентрированный куб (ГЦК) (рис. 1.2, б), атомы располагаются в вершинах куба и по центру каждой из шести граней (Ag, Au, Feγ,, Cu, Co, Ni и др.).
а б в
Рис. 1.2. Основные типы кристаллических решеток:
а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная плотноупакованная
3. Гексагональная, в основании которой лежит шестиугольник:
– простая – атомы располагаются в вершинах ячейки и по центру двух оснований (углерод в виде графита);
– плотноупакованная (ГПУ) – имеется три дополнительных атома в средней плоскости (Zn, Mg, Ti).
 2020-05-11
2020-05-11 419
419







