Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
2H+ + CO32- → CO2↑ + H2O
1. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
2. Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
3. Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
1. Диссоциации не подвергаются: оксиды, газообразные вещества, вода, нерастворимые в воде соединения
2. Реакция ионного обмена идёт до конца если образуется: газ, осадок, вода
3. В ионных уравнениях слабые электролиты записывают в молекулярной форме, а сильные – в ионной!


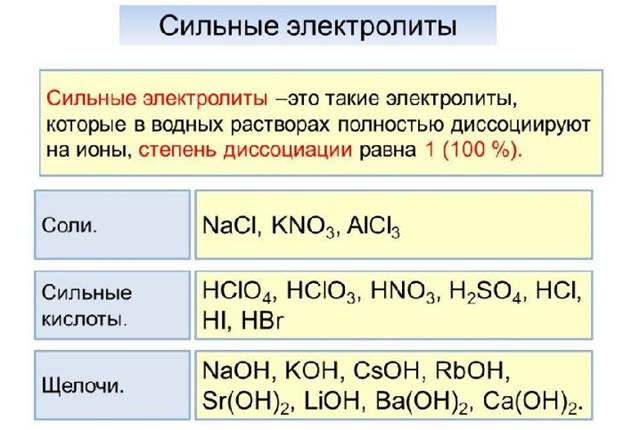
Степень диссоциации сильных электролитов больше 0,3 или 30 %. Они диссоциируют практически полностью. Диссоциация в этом случае необратима.
Список сильных электролитов:
- неорганические соли, растворимые в воде –
Са(NO3)2, Na2SO4, NaCl, K2S, AlBr3, Cr2(SO4)3;
- сильные неорганические кислоты –
HCl, HBr, HI, H2SO4, HNO3, HClO4, HMnO4;
- гидроксиды щелочных и щелочноземельных металлов (щёлочи) –
KOH, RbOH, Ca(OH)2, Sr(OH)2.
Слабые электролиты:
- нерастворимые соли
- нерастворимые гидроксиды
-слабые кислоты
Задание 31 ЕГЭ
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ:
- Для выполнения задания используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, кремнезём, нитрит калия. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: йодид калия, серная кислота, гидроксид алюминия, оксид марганца (IV), нитрат магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, оксид фосфора (V), оксид марганца (IV), фторид аммония, нитрат кальция. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: дихромат натрия, серная кислота, йодид натрия, силикат натрия, нитрат магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, углекислый газ, перманганат калия, фторид аммония, нитрат железа. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди (II). Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора (V), нитрат меди (II). Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, фтороводород, карбонат аммония, сульфат железа (II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома (III), оксид магния. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, сульфит калия, дихромат калия, серная кислота, гидроксид хрома (III), кремнезём. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, бром, нитрат бария, сульфат аммония, соляная кислота концентрированная, перманганат калия. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, сера, азотная кислота концентрированная, углекислый газ, фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома (III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
- Для выполнения задания используйте следующий перечень веществ: сероводород, хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ.
 2020-05-13
2020-05-13 257
257






