I. Прочитать условие задачи
II. Сделать краткую запись условия задачи по схеме:
Дано:
m р-ра(HCl) = 36,5г
W(HCl) = 10% = 0,1
Найти: 
V(H2) −?
III. Решить задачу по памятке:
1. Если вещество дано в виде смеси (раствора), найти массу (объем) чистого вещества по формулам:
а) mв-ва =  б) mв-ва =
б) mв-ва =  в)
в) 
m(HCl) = 36,5∙0,1 = 3,65г
2. Для вещества в чистом виде найти количество вещества по формулам:
а) если это масса вещества: n =  ,
,
б) если это объем вещества: n = 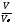 ,
,
в) если это число частиц: n =  ,
,
Mr(HCl)=1+35,5=36,5 => M(HCl)=36,5г/моль => n (HCl)= 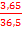 = 0,1 моль
= 0,1 моль
3. Составить уравнение химической реакции. Обязательно проверить правильность расстановки коэффициентов:
Zn + 2HCl = ZnCl2 + H2↑
4. Записать данные выраженные в молях в уравнение реакции:
а) данные по условию задачи (известные и неизвестные) записать над формулами соответствующих веществс единицами измерения.
0,1 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
б) данные по уравнению реакции записать под формулами веществ (количество вещества определить по коэффициентам перед формулами соответствующих веществ).
Zn + 2 HCl = ZnCl2 + 1 H2↑
2 моль 1 моль
5. Составить и решить пропорцию:
а) левую часть пропорции записать по одному веществу;
б) правую часть пропорции записать по другому веществу;
в) одна из частей пропорции (левая или правая) должна содержать известные величины.
(HCl)  (Н2)
(Н2)
Х=  (n(H2))
(n(H2))
6. Найти данные, требуемые в задаче, использую одну из формул:
а) масса вещества: m = n∙M;
б) объём вещества: V = n∙Vm
в) число частиц (молекул, атомов, ионов) N = n∙Na
V(H2) = 0,05моль∙ 22,4 л/моль= 1,12л
IV Записать ответ задачи.
Ответ: V(H2) = 1,12л
КРАСНЫМ ЦВЕТОМ написано решение задачи (то что должно быть и в вашем решении.
А теперь попробуйте самостоятельно решить следующие задачи.
Оформить их нужно ТАК КАК В ЭТОМ АЛГОРИТМЕ, СТРОГО СЛЕДУЙТЕ АЛГОРИТМУ!!!
Решение задач другими способами приниматься не будет
1. Какая масса хлорида серебра образуется при взаимодействии избытка раствора нитрата серебра и 200 г раствора соляной кислоты с массовой долей кислоты 25%? (AgNO3+HCl=AgCl+HNO3)
2. Чему равна масса сульфата натрия в растворе, если для реакции нейтрализации использовали 8 г 10%-ного раствора гидроксида натрия? (H2SO4 + 2NaOH = Na2SO4 + 2H2O)
Фото решения или текстовый документ отправляйте в ЭЛЖУР или на мою электронную почту ccveta@inbox.ru.
 2020-05-21
2020-05-21 63
63






