Способы получения и применение кислот».
В своей работе вы можете использовать учебник (п.44-45, с.149-154)и материал, который я выложила в группе
или использовать материал на сайте Я-Класс. https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/kisloty-13840
Вопросы и рекомендации для составления конспекта.
Задание выполняйте в своих тетрадях.
1. Кислоты-это ………………………………………………………………………..
2. Кислоты с точки зрения ТЭД – это …………. https://www.yaklass.ru/p/himija/89-klass/rastvory-58606/elektroliticheskaia-dissotciatciia-kislot-osnovanii-i-solei-102805/re-3b3ab4d3-5a46-45f5-971b-8c15b797343e
Привести примеры кислот, которые являются сильными электролитами.
2. Агрегатное состояние кислот, цвет. Сделать кратко, желательно в виде таблицы.
3. Классификация кислот. Привести примеры. Желательно тоже в виде таблицы.
Химические свойства кислот.
ü Каждое свойство обязательно подтверждайте двумя уравнениями реакций.
ü Реакции, протекающие между растворами электролитов, записывайте в молекулярном и ионном виде.
ü Не забывайте расставлять коэффициенты, указывайте условия взаимодействия
4.1 Действие кислот на индикаторы (таблицу переписать в тетрадь)
Написать диссоциацию одноосновной и двухосновной кислот.
!!! Не забудь! Диссоциацию сильных кислот записываем, используя одну стрелку или знак равенства.
Например: 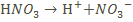 или
или 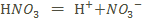
Диссоциацию кислот как средних и слабых электролитов записываем так:
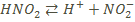
Взаимодействие кислот с металлами.
Например:
| кислота | металл | соль | ||||
| * H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов левее водорода. В результате реакции образуется соль и выделяется водород.
** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это же наблюдается и для реакций концентрированной серной кислоты. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
* Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
4.3 Взаимодействие кислот с основными и амфотерными оксидами.
Кислоты реагируют с основными и амфотерными оксидами. В результате реакции обмена образуются соль и вода.
Примеры уравнений реакции… в молекулярном и ионном виде …..
4.4 Взаимодействие кислот с основаниями и с амфотерными гидроксидами.
Реакция нейтрализации - это
Примеры уравнений реакции… в молекулярном и ионном виде …..
 2020-05-21
2020-05-21 135
135







