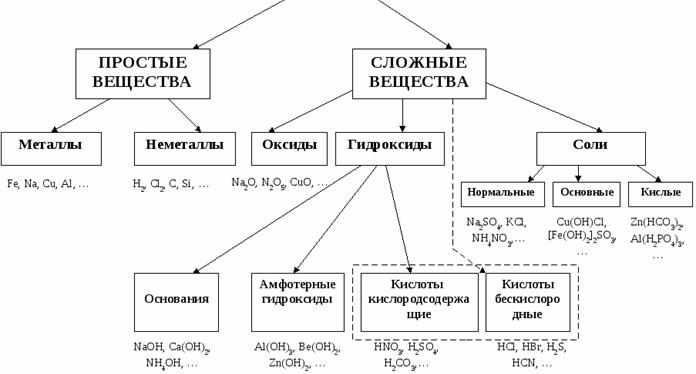
Классификация сложных неорганических веществ.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Например: H2, O2
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ. Например: NaOH, BaCl2
Схема 1
Классификация неорганических веществ
|
|
Общая характеристика оксидов
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства.
Таблица 1
Классификация оксидов
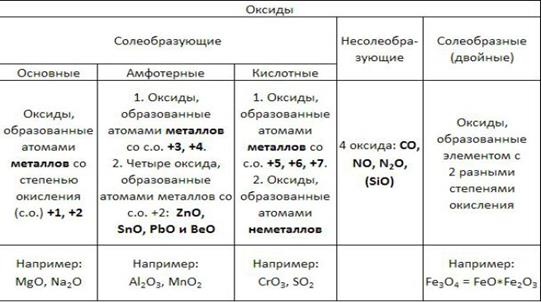
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид — металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Каждому солеобразующему оксиду соответствует гидроксид:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO- основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH. Получаем: Cr(OH)2. Оксид хрома (III) -Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который, в зависимости от реакции, может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2. Формулу кислоты выводим, просто добавляя к формуле оксида воду: Cr2O3+H2O = H2Cr2O4, и делим все индексы в формуле на 2, если он не равен 1: HCrO2. Данной кислоте соответствует кислотный остаток хромит-ион CrO2—. Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
|
|
|
+ +
 2020-05-25
2020-05-25 291
291






