НЕКОТОРЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Атомная единица массы (а. е. м.)
Массы отдельных атомов и молекул удобно измерять не в килограммах, а в относительных единицах – в атомных единицах массы.
Определение. Единица, равная 1/12 массы атома углерода С12, называется атомной единицей массы (а.е.м.). В абсолютном выражении
1 а.е.м. = 1,66·10−27 кг.
С точностью до 0,7% за 1 а.е.м. можно принять массу протона:
1 а.е.м. ≈ m p = 1,67·10−27 кг.
Относительные атомные массы элементов, т. е. массы атомов, выраженные в а.е.м., указаны в таблице Менделеева.
Моль. Число Авогадро
В системе СИ количество вещества (не масса) измеряется в молях.
Определение. Количество вещества, содержащее столько его структурных единиц (молекул), сколько атомов С12 в 12 г углерода, называется молем этого вещества (1кмоль = 1000 моль).
А интересно, − сколько же атомов С12 содержится в 12 г углерода? Это число называется числом Авогадро, N A. Опытным путём найдено, что
N A = 6,02·1023 (молекул в моле) ≈ 6·1023 моль−1.
Таким образом, по определению, число N А есть количество структурных единиц (молекул) вещества в одном его моле. Например, 1 моль меди содержит N A атомов Сu, 1 моль углерода − N A атомов С, 1 моль молекулярного кислорода содержит N A молекул О2.
3. Молярная масса.
Определение. Масса (в килограммах) одного моля вещества называется его молярной массой (М):
М = m N A,
где m – масса молекулы данного вещества в килограммах. Так например, М Cu = 64 г/моль = 0,064 кг/моль,  = 2 г/моль,
= 2 г/моль, 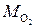 = 32 г/моль. Видно, что моль меди в 2 раза тяжелее моля кислорода, хотя и там, и там содержится одинаковое число молекул – по 6·1023 штук.
= 32 г/моль. Видно, что моль меди в 2 раза тяжелее моля кислорода, хотя и там, и там содержится одинаковое число молекул – по 6·1023 штук.
4. Оценка размеров молекул.
Оценим характерные размеры молекул на примере молекулы Н2О. Так как 1 моль воды (т. е. 18 граммов) занимает объём V = 18 см3 = 18·10−6 м3, то на одну молекулу Н2О приходится объём  = V / N A=30·10−30 м3. Тогда характерные линейные размеры молекулы Н2О
= V / N A=30·10−30 м3. Тогда характерные линейные размеры молекулы Н2О
l ~  м = 0,3 нм = 3 Å.
м = 0,3 нм = 3 Å.
Молекулы других веществ имеют размеры того же порядка.
ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Понятие термодинамической системы
Далее мы будем рассматривать тепломеханические свойства термодинамических систем. В общем смысле, с истема – это некоторое множество элементов, как-либо взаимодействующих друг с другом. Термодинамическая система – это любое твёрдое, жидкое или газообразное тело, свойства которого мы собираемся описывать; или же несколько тел, например, система «пар-жидкость» (гетерогенные системы).
Однако далее мы будем рассматривать только однородные (гомогенные) системы, состоящие к тому же из молекул одного химического вещества. При этом предполагается, что термодинамическая система содержит очень большое число молекул, порядка N А, так как при малом числе молекул будет меньшая точность термодинамических законов.
Число частиц в системе предполагается фиксированным.
 2020-05-21
2020-05-21 125
125







