Лекция № 15
Тема: Методы окислительно-восстановительного титрования
(методы броматометрии, нитритометрии)
План.
1. Теоретические основы метода броматометрии.
2. Использование метода в анализе лекарственных средств.
3. Теоретические основы метода нитритометрии.
4. Условия титрования в методе нитритометрии.
5. Определение точки эквивалентности.
6. Использование метода в анализе лекарственных средств.
Теоретические основы метода броматометрии.
В основе метода лежит реакция восстановления бромат-иона в кислой среде до бромид иона.
BrO3- + 6H+ +6e →Br- + 3H2О;
Титрантом является КBrO3 с С1/z = 0,1 моль/л.
M 1|z (КBrO3 ) = M* fЭ = 167*1/6+27,83
Рабочий раствор готовят по точной навеске КBrO3, которую растворяют в части очищенной воды и доводят в мерной колбе до нужного объема.
Водные растворы КBrO3 устойчивы, их хранят в сосудах, темного стекла с притертыми пробками защищенном от света месте.
Для проверки концентрации приготовленного раствора бромата калия, проводят йодометрическое титрование по заместителю. С этой целью к раствору приливают раствор иодида калия и выделившийся йод титруют тиосульфатом натрия.
КBrO3 +6KI +3 H2SO4 →3I2 + KBr+ 3 K2SO4 + 3 H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Т.к. исходным веществом в методе броматометрии является титрованный раствор Na2S2O3.
Использование метода в анализе лекарственных средств.
Броматометрический метод титрования применим для веществ с ненасыщенными углерод- углеродными связями, ароматических соединений (фенолы, фенолокислоты, ароматические амины).
При прямом титровании,например тиомочевины, щавелевой кислоты броматом калия лишняя капля BrO3- вступает в реакцию с образующимся в растворе бромид –ионом. Выделяется свободный Br2, который может быть обнаружен по появлению желтой окраски.
BrO3- + 5Br- + 6H+ → 3Br2 + 3H2О;
Определить точно ТЭ без индикаторов нельзя. Используют –азоиндикаторы: метиловй красный, м/ оранж.В Т.Э избыток бром разрушает индикаторы, раствор обесцвечивается. Окраска индикатора не восстанавливается.
Способом прямой броматометрии анализируют неорганические соединения Аs и элементорганические соединения Аs после минерализации.
Способом заместительной броматометрии анализируют органические ЛС:
- производные С6Н5ОН: тимол, резорцин
- производные первичн. ароматических аминов: САП (сульфаниламидные препараты), ПАБК, Na парааминосалицилат.
При обратной броматометрии конец титрования устанавливают йодометрически, добавляя в титруемый раствор КI. Этот способ часто называют методом броматометрии с йодометрическим окончанием.
Например, резорцин, тимол, салициловая кислота, стрептоцид непосредственно с броматом не реагируют, но количественно реагируют с бромом.
К подкисленному раствору анализируемого вещества прибавляют избыток бромида калия и бромата калия с известной концентрацией,выделяется эквивалентное количество брома(1).
Полученный раствор брома точно определенной концентрацией вступает в реакцию с органическими веществами(2). Избыток непрореагировавшего брома, определяют добавляя к смеси раствор иодида калия. Бром вытесняет молекулярный йод из йодида калия(3). Выделившийся йод оттитровывают раствором тиосульфата натрия.(4) При определении резорцина (фенола) протекают четыре реакции:
BrO3- + 5Br- + 6H+ → 3Br2 + 3H2О;(1)
C6H4- (OH)2 + Br2→ 2,4,6- трибромрезорцин.(2)
2KI+ Br2→ KBr + I2 (3)
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 (4)
Косвенно методом броматометрии можно определять многие Ме: Мg, Al, Zn,Cu,Cd и др. После осаждения их 8-оксихинолином.
Теоретические основы метода нитритометрии.
Определение основаано на способности первичных ароматических аминов образовывать в кислой среде диазосоединения.
В основе метода лежит реакция диазотирования.


 NH2 +NºN
NH2 +NºN
 | |||
 | |||

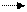
 + NaNO2 + 2HCl Cl- + NaCl + 2H2O
+ NaNO2 + 2HCl Cl- + NaCl + 2H2O
 |  |
R R
Титрант метода является раствор NaNO2 с С1/z 0,5 моль/л, 0,05 моль/л. Титрант хранят в хорошо укупоренной таре.
Концентрацию раствора NaNO2 устанавливают по исходному веществу – сульфаниловой кислоте:
HO3S-C6H4-NH2 + NaNO2 +2HCl→ HO3S-C6H4 -NºNCl+ NaCl + 2H2O
4. Условия титрования:
1) Определенная скорость титрования В начале титруют с 2мл/мин ~ 40 кап/мин, а в конце титрования ~ за 0,5 мл до точки эквивалентности с 0,05 мл/мин, т.е 1 кап/мин.
2) наличие катализатора. Т.к реакция диазотирования протекает очень медленно, то для ее ускорения добавляют катализатор KBr.
3) определенная температура. Обычно титруют при t 15-20 С. В некоторых случаях требуется охлаждение до 0-5С.
 2020-05-21
2020-05-21 765
765







