Здравствуйте, ребята! Запишите тему урока. Вспомните что такое электроотрицательность (устно) и выполните письменно задание 1 § 55, стр. 193.
На прошлом уроке вы узнали о том, что электроны внешнего энергетического уровня участвуют в образовании химических связей. Электроны внешнего энергетического уровня называются валентными. Их количество для химических элементов главных подгрупп равно номеру группы.
Теория в ЯКласс:
https://www.yaklass.ru/p/himija/89-klass/stroenie-veshchestva-18844/tipy-khimicheskoi-sviazi-18860/re-bd8ad0ba-1fcf-451f-aee2-4f5a32afafc2
https://www.yaklass.ru/p/himija/89-klass/stroenie-veshchestva-18844/tipy-khimicheskoi-sviazi-18860/re-23c0f5df-b56c-4d87-b085-cedb3e307fa1
Химическая связь — это взаимодействие, которое объединяет атомы в более сложные системы — молекулы или кристаллы (запишите в тетрадь).
Причиной образования химической связи является стремление атомов к стабильной электронной конфигурации внешнего энергетического уровня (правило «дуплета и октета»). Для этого атомы неметаллов присоединяют электроны, чтобы на внешнем уровне стало два (у водорода) или восемь электронов(у всех остальных элементов). Атомы металлов, наоборот, отдают свои внешние электроны. При этом внешним становится предвнешний заполненный уровень.
Какие химические элементы имеют 8-ми электронную оболочку и практически не вступают в образование химических связей? (Инертные газы (VIII группа, главная подгруппа, ПСХЭ).
Химическая связь (запишите классификацию в тетрадь)
 |  |  | |||

 ковалентная ионная металлическая
ковалентная ионная металлическая
неполярная полярная
Работая с учебником § 56, стр. 194-196, выпишите в тетрадь определение понятия ковалентная связь. Запишите в каком случае образуется неполярная ковалентная связь, а в каком полярная ковалентная связь, дайте определения понятиям общая электронная пара, электронные формулы, диполь.
Химия 8 класс Тема: Ионная связь 06.05.20
Работая с учебником § 56, стр. 196-197 (до «Валентность элементов в свете представлений о строении атома») запишите в тетрадь определения понятий «ионная связь» и «ионные соединения».
Алгоритм составления электронной формулы молекулы бинарного соединения (прочитайте):
1. Записать знаки химических элементов (например, Н)
2. Изобразить точками вокруг химического элемента электроны внешнего энергетического уровня (смотрим по номеру группы (для элементов главных подгрупп), например у H один электрон, рядом ставим одну точку, изображаем, как H. )
3. Изображаем неспаренные электроны разных элементов в виде общих электронных пар этих элементов; обводим в кружки химические элементы вместе со всеми их электронами.
4. Рисуем черточками химические связи: 1 пара электронов (общая) = 1 химическая связь.
Например:
Образование химической связи между двумя атомами:

 а) водорода
а) водорода
Н∙ + ∙Н → Н: Н → Н – Н → Н2
б) кислорода
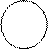
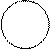 ̤ ̤ ̤ ̤
̤ ̤ ̤ ̤
: О: +: О: →: О:: О: → О = О → О2
Выполните письменно в тетради задание 2 § 56, стр. 198.
Домашнее задание: прочитать § 56, стр. 194-197 (читать до «Валентность элементов в свете представлений о строении атома»).
 2020-06-12
2020-06-12 100
100






