Дисперсные системы
Дисперсными называют системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом веществе (дисперсионная среда).
Классификация дисперсных систем
По размеру частиц дисперсной фазы (d)дисперсные системы делятся на грубодисперсные, коллоидные и истинные растворы.
| Грубодисперсные (ГД) | Коллоидные растворы | Истинные растворы |
| d > 10-7м | d =10-7 - 10-9 м | d < 10-9 м |
| Взвесь глины, мела в воде, эмульсия жира в молоке | Вирусы, гемоглобин крови, нервные клетки, протоплазма | Растворы солей, кислот, оснований, глюкозы |
Классификация коллоидных растворов
1. По агрегатному состоянию фаз
| Агрегатное состояние дисперсионной среды и тип системы | Агрегатное состояние дисперсной фазы условное обозначение | Название системы | Пример |
| Жидкость Лиозоли | Твердое Т/Ж Жидкость Ж/Ж Газ Г/Ж | Золи, суспензии Эмульсии Пены | Золи металлов Молоко, смазки Мыльная пена |
| Газ Аэрозоли | Твердое Т/Г Жидкость Ж/Г Газ Г/Г | Аэрозоль Аэрозоль – | Дым, пыль Туман, облака – |
| Твердое Солидозоли | Твердое Т/Т Жидкость Ж/Т Газ Г/Т | – Твердые эмульсии Твердые пены | Сплавы Почва, жемчуг Пемза, уголь активированный |
2. По характеру взаимодействия фазы и среды системы бывают лиофобными и лиофильными, если дисперсионная среда – вода, то соответственно – гидрофобными и гидрофильными.
В лиофобных системах частицы фазы слабо взаимодействуют или не взаимодействуют со средой. Эти системы необратимы и термодинамически неустойчивы. Примеры: гидрозоли серебра, золота, хлорида серебра AgCl.
В лиофильных системах взаимодействие частиц фазы со средой достаточно сильное, т.е. частицы фазы сильно сольватированы (гидратированы). Такие системы являются термодинамически устойчивыми и обратимыми (восстанавливаются при добавлении растворителя после его испарения). Примеры: растворы белков, полисахаридов, нуклеиновых кислот в воде.
2.2. Методы получения
коллоидных растворов
Коллоидные растворы (золи) можно получить:
1) из грубодисперсных систем путем диспергирования (измельчения)частиц дисперсной фазы – это диспергационныеметоды;
2) из истинных растворов путем конденсации (укрупнения)частиц – конденсационныеметоды.
Методы диспергирования
1. Механическое дробление в шаровых и коллоидных мельницах.
2. Измельчение под действием ультразвука.
3. Электрическое диспергирование.
Перечисленные методы используются для получения золей металлов, полимеров (крахмала, каучука, нитроцеллюлозы), при производстве лекарственных препаратов, краски, цемента и т.д.
4. Пептизация – перевод свежеполученного осадка в золь под действием пептизатора- стабилизатора.
Пример: расщепление сложных белков на более простые под действием пепсина, получение гидрозоля из осадка Fe(OH)3 под действием пептизатора FeCl3.
Конденсационные методы
1. Физическая конденсация заключается в замене растворителя (дисперсионной среды).
Пример: раствор NaCl в воде – истинный раствор, в бензоле – коллоидный раствор.
См. опыт 1, стр. 45. Получение золя канифоли.
2. Химическая конденсация – получение золей в химической реакции (гидролиза, окислительно-восстановительной, обменной) при следующих условиях:
1) образование труднорастворимого вещества;
2) наличие стабилизатора (избыток одного из реагентов, ПАВ);
3) малые концентрации растворов (для получения d частиц 10-7-10-9 м).
2.3. Методы очистки
коллоидных растворов
От грубодисперсных частиц очищают путем фильтрации. Коллоидные растворы проходят через фильтр, крупные частицы задерживаются.
От низкомолекулярныхпримесей коллоиды очищают методами диализа, электродиализа, ультрафильтрации, компенсационного диализа.
Диализ основан на свойстве полупроницаемых мембран задерживать коллоидные частицы и пропускать молекулы или ионы низкомолекулярных веществ в растворитель, циркулирующий в диализаторе.
Электродиализ – это ускоренный диализ под действием электрического тока (продолжительность диализа – недели, месяцы, электродиализа – минуты, часы).
Ультрафильтрация – это диализ под давлением или при разрежении. Этот метод широко используют для очистки воды, белков, нуклеиновых кислот, витаминов, для определения размеров вирусов.
Компенсационный диализ или вивидиализ – это очистка от части низкомолекулярных примесей. В диализаторе растворитель заменяется раствором низкомолекулярного вещества, которое необходимо оставить в коллоидном растворе.
Вивидиализ применяется для количественного определения веществ в биологических жидкостях. Например, содержание сахара в крови определяется диализом сыворотки крови по сравнению с физиологическим раствором, к которому добавляют различные количества сахара. Концентрация сахара во внешнем растворе не изменяется лишь в том случае, когда она равна концентрации свободного сахара в крови.
По принципу компенсационного диализа работает аппарат «искусственная почка» (АИП), применяемый при острых отравлениях, обширных ожогах, токсикозах для очистки крови (гемодиализа) от шлаков: мочевины, мочевой кислоты, билирубина и т.д. Внешним диализирующим раствором является физиологический раствор (0,85% NaCl).
2.4. Молекулярно-кинетические
свойства коллоидных растворов
Броуновское движение – хаотическое тепловое движение коллоидных частиц вследствие ударов о них молекул растворителя.

Интенсивность броуновского движения оценивается средним квадратичным проекции смещения частицы 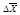 по формуле Эйнштейна – Смолуховского:
по формуле Эйнштейна – Смолуховского:
 ,
,
где К Б – константа Больцмана (1,38×10-23 Дж/К), t – время (с), Т – температура (К), r – радиус частицы (м), h – вязкость среды (Н×с/м2 ).
Благодаря броуновскому движению коллоидные частицы находятся во взвешенном состоянии, коллоидный раствор обладает кинетической устойчивостью.
Диффузия – самопроизвольный процесс выравнивания концентрации частиц во всем объеме раствора. Cкорость диффузии увеличивается с повышением температуры и уменьшением размера частиц и вязкости среды:
 ,
,
где D – коэффициент диффузии (м2/с), К Б – константа Больцмана (1,38×10-23 Дж/К), Т – температура, r – радиус частицы (м), h – вязкость среды (Н×с/м2).
Осмотическое давление коллоидных растворов подчиняется закону Вант-Гоффа:
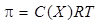 ;
;  ;
;  ,
,
где n – число частиц в единице объема, N A – число Авогадро (6,02 ×1023 молекул).
Из-за большого размера и малой концентрации коллоидных частиц осмотическое давление коллоидных растворов значительно меньше осмотического давления истинных растворов.
Седиментационное равновесие – это протекание противоположных процессов: диффузии и седиментации. Седиментация – оседание частиц под действием силы тяжести. По закону Стокса на частицу действуют сила тяжести и сила трения:
F трения = 6p r h u.
При оседании с постоянной скоростью F трения = F тяжести. Из уравнения Стокса cледует, что скорость седиментации (u) прямо пропорциональна размеру частиц, разности плотностей дисперсной фазы и дисперсионной среды и обратно пропорциональна вязкости раствора.
 ,
,
где U – скорость седиментации (м/с), r – радиус сферической частицы дисперсной фазы (м), r и r0 –плотность дисперсной фазы и среды соответственно (кг/м3), g – ускорение силы тяжести (9,8 м/с2), h – вязкость (Н ×с/м2).
Определение скорости седиментации лежит в основе седиментационного анализа, который используется:
1) для определения скорости оседания эритроцитов СОЭ (в норме у женщин – 3-12 мм/ч, у мужчин – 2-6 мм/ч);
2) для разделения на фракции центрифугированием компонентов клетки, крови, костного мозга;
3) для выделения белков, ДНК, вирусов.
2.5. Оптические свойства
коллоидных растворов
Оптические свойства коллоидных растворов существенно отличаются от свойств истинных растворов.
Размеры коллоидной частицы соизмеримы с длиной волны падающего света 2 r» l. Частица становится вторичным источником света, в коллоидах наблюдается дифракционное рассеяние света. Визуально наблюдается опалесценция – различная окраска золей в проходящем свете (напротив источника света) и в рассеянном свете (сбоку). Это явление было обнаружено Фарадеем и Тиндалем:

При боковом освещении коллоидного раствора хорошо виден светящийся конус Тиндаля.
Интенсивность светорассеяния количественно выражается уравнением Рэлея
 ,
,
где I, I0 – интенсивность рассеянного и падающего света (Вт/м2), К Р – константа Рэлея, n – число частиц в 1 м3, V –объем частицы (м3), l – длина волны падающего света (м).
Из уравнения Рэлея следует, что I рассеянного света обратно пропорциональна l4 (I ~ 1/l4 ), следовательно, сильнее всего рассеиваются волны синей и фиолетовой части спектра (окраска золя в рассеянном свете). Незначительное рассеивание красного и желтого цветов объясняет окраску коллоидного раствора в проходящем свете.
Явление светорассеяния лежит в основе работы ультрамикроскопа, применяемого для определения размеров частиц плазмы, сыворотки крови, лимфы, вакцин и для контроля чистоты инъекционных растворов.
Строение мицеллы
Мицелла – это сложная коллоидная частица. Основой мицеллы является электронейтральный агрегат – совокупность атомов или молекул труднорастворимого вещества.
AgNO3 + KI ¾® AgIтв + KNO3.
стабилизатор агрегат
(в избытке)
Коллоидная частица образуется только при избытке одного из реагентов, т.е. в присутствии стабилизатора. На поверхности агрегата избирательно адсорбируются потенциалопределяющие ионы (ПОИ) по правилу Панета – Фаянса (в данном случае – ионы I-), в результате чего агрегат приобретает заряд. Агрегат и ПОИ образуют ядро мицеллы.
С заряженной поверхностью ядра устойчиво связано некоторое количество ионов противоположного знака – противоионов (в данном примере – ионы К+). ПОИ и часть противоионов формируют адсорбционный слой. Агрегат вместе с адсорбционным слоем называют гранулой.
Знак заряда гранулы определяется знаком потенциалопределяющих ионов (ПОИ). Заряд гранулы компенсируют остальные противоионы, образующие подвижный диффузный слой. Диффузный слой насыщен молекулами растворителя.
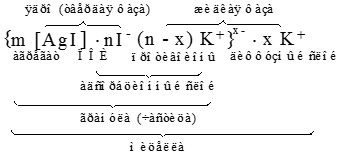
 2020-06-12
2020-06-12 3196
3196