УРОК №
Тема: «Металлы – простые вещества»(урок повторение).
Изучаем материал.
Делаем конспект урока.
Дом. Задание подготовиться к КР
Металлы составляют одну из основ цивилизации на планете Земля. С ними человек познакомился приблизительно за 7000-5000 лет до н.э., когда огонь уже использовался для обработки руд, отделения металлов от примесей. Первыми металлами, с которыми столкнулся человек, были золото, серебро, ртуть, медь, железо, олово и свинец. Эти элементы можно назвать доисторическими, так как они применялись человеком ещё до изобретения письменности. Астрологи того времени утверждали, что каждой планете на небе соответствует свой металл на Земле, например, красноватому Марсу – гремящее в боях железо. Каждая планета издревле обозначалась особым знаком. Этими же знаками обозначали и «родственные» этим планетам металлы
На часах человеческой истории каменный век сменился медным, затем бронзовым и железным.
Металлы составляют фундамент нашего общества. Без металлов не было бы автомобилей, самолётов, невозможно строительство и в быту мы постоянно пользуемся изделиями из металлов. Это ложки, вилки, ножи, кастрюли, сковородки и т.д.
Если в провести диагональ от бора до астата, то слева внизу под этой диагональю в Периодической системе все элементы являются металлами, кроме этого металлами являются все элементы побочных подгрупп. Справа вверху над диагональю находятся элементы неметаллы (исключая металлы побочных подгрупп).
Вопрос: каких элементов в Периодической системе химических элементовД.И. Менделеева больше? (Металлов)
Вопрос: как изменяются по периоду металлические свойства химических элементов?(Слева направо уменьшаются).
Вопрос: как по группе изменяются металлические свойства химических элементов?(Сверху вниз по группе металлические свойства химических элементов увеличиваются).
Вопрос: где в Периодической таблице находятся самые активные металлы?
(В первой группе главной подгруппе).
Вопрос: какой металл самый активный?(Франций).
Вопрос: почему металлы первой группы главной подгруппы самые активные металлы? (На внешнем энергетическом уровне один электрон, который они легко будут отдавать, чтобы их внешний энергетический уровень стал устойчивым).
Вопрос: зная, что металлы имеют сравнительно большие радиусы атомов и небольшое количество электронов на внешнем энергетическом уровне к чему стремятся атомы металлов?
(Атомы металлов отдают электроны внешнего энергетического уровня).
Вопрос: во что превратятся атомы металлов, отдавшие электроны?
(В положительно заряженные ионы)
Вопрос: что же удерживает атомы металлов в единое целое? Давайте вспомним строение кристаллической решетки металлов. (Кристаллическая решетка металлов имеет следующее строение: в узлах находится положительные ионы и атомы металлов, а между узлами – электроны. Эти электроны могут свободно перемещаться по всему кристаллу металла и поэтому называются свободными электронами, или «электронным газом». Свободные электроны имеют отрицательный заряд и притягивают катионы металлов, в результате чего кристаллическая решетка металлов является устойчивой).
Вопрос: как называется связь между положительными ионами металлов и свободными электронами в кристаллической решетке металлов? (Металлическая связь).
Вывод:свободные электроны внутри металлической кристаллической решетки могут переносить теплоту и электричество, отражать световые волны, поэтому они являются причиной главных физических свойств, отличающих металлы от неметаллов, – высокой электро- и теплопроводностью.
- Агрегатное состояние (все металлы при обычных условиях являются твёрдыми веществами, кроме ртути)
- Температуры плавления и кипения (В зависимости от температуры плавления металлы условно делятся на:
1) Легкоплавкие (температура плавления до 1539°С).
К легкоплавким металлам относятся: ртуть — температура плавления —38,9°С; галлий — температура плавления 29,78°С; цезий — температура плавления 28,5°С; и другие металлы.
2) Тугоплавкие (температура плавления выше 1539 С).
К тугоплавким металлам относятся: хром — температура плавления 1890°С; молибден — температура плавления 2620°С; ванадий — температура плавления 1900°С; тантал — температура плавления 3015°С; и многие другие металлы.
Самый тугоплавкий металл вольфрам — температура плавления 3420°С.
- Твердость (Металлы различаются по своей твердости:
— мягкие: режутся даже ножом (натрий, калий, индий);
— твердые: металлы сравниваются по твердости с алмазом, твердость которого равна 10. Хром — самый твердый металл, режет стекло.
- Плотность металлов (В зависимости от своей плотности металлы делятся на:
Легкие (плотность не более 5 г/см)
К легким металлам относятся: литий, натрий, калий, магний, кальций, цезий, алюминий, барий.
Самый легкий металл — литий 1л, плотность 0.534 г/см3.
Тяжелые (плотность больше 5 г/см3).
К тяжелым металлам относятся: цинк, медь, железо, олово, свинец, серебро, золото, ртуть и др.
Самый тяжелый металл — осмий, плотность 22,5 г/см3.
- Электро- и теплопроводность (Теплопроводность и электропроводность уменьшается в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Металлы звенят – это свойство используется для изготовления колоколов, музыкальных инструментов и т.д. Cамые звонкие металлы – это золото, серебро и медь. Медь звенит густым гудящим звоном – «малиновым звоном». Малиновый звон, но не в честь ягоды - малины, а в честь голландского города Малина, из которого привозили первые церковные колокола в Россию. Потом русские мастера стали лить колокола даже лучшего качества, а жители городов и поселков жертвовали золотые и серебряные украшения, чтобы отливаемые для храмов колокола звучали лучше.
Пластичность, ковкость – это важнейшее свойство металлов изменять свою форму при ударе. Прокатываться в тонкие листы и вытягиваться в проволоку. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи и поэтому металл характеризуется высокой пластичностью. Самым пластичным из драгоценных металлов является золото. Один его грамм можно вытянуть в проволоку длиной 2 км. (Демонстрация алюминиевой фольги). Алюминиевая фольга появилась сравнительно недавно и раньше чай, шоколад паковали в фольгу из олова.
Металлический блеск – все металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и его электроны начинают испускать свои вторичные волны излучения, которые мы воспринимаем как металлический блеск. Самые блестящие металлы – это ртуть и серебро. Из ртути изготавливали в средние века знаменитые «венецианские зеркала», современные зеркала изготавливают из серебра.
Для всех металлов характерна металлическая кристаллическая решетка: в ее узлах находятся положительно заряженные ионы, а между ними свободно перемещаются электроны. Наличие последних объясняет высокую электропроводность и теплопроводность, а также способность поддаваться механической обработке.
В главной подгруппе:
- число ẽ на внешнем уровне не изменяется;
- R атома увеличивается; - электроотрицательность уменьшается;
- восстановительные свойства усиливаются;
- Ме свойства усиливаются.
В периоде:
- заряды ядер атомов увеличиваются;
- R атомов уменьшаются;
- число ẽ на внешнем слое увеличивается;
- электроотрицательность возрастает;
- восстановительные свойства уменьшаются;
- Ме свойства ослабевают.
Для атомов Ме характерны исключительно восстановительные свойства (т.е. способность отдавать ẽ и превращаться в катионы +).
Восстановительную активность Ме отражает
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
→ Ослабление восстановительных свойств
→ Усиление окислительных свойств
(активность Ме в водных растворах при стандартных условиях Т=250 С, Р= 1 атм)
1. Чем левее Ме, тем он более сильный восстановитель
2. Каждый Ме способен вытеснять (восстанавливать) Ме, который стоит правее (аналогично вытесняет Н из кислот)
3. Ме щелочные и щелочно-земельные в водных растворах реагируют прежде всего с водой
с кислородом активно при комнатной температуре реагируют только щелочные металлы, при этом образуются оксиды или пероксиды.

Большинство металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются соответствующие сульфиды.

Практически все металлы реагируют с галогенами. Условия протекания этих реакций зависит от активности металла и галогена. Например, кальций реагирует с йодом при комнатной температуре, при этом образуется йодид кальция, а золото реагирует с хлором при сильном нагревании, при это образуется хлорид золота (III). Очень красиво горит сурьма в хлоре, при этом образуется смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).

При нагревании металлы реагируют и с другими неметаллами. Так, в реакции алюминия с азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции магния с кремнием – силицид магния.

С водородом реагируют только активные металлы. Например, в реакции натрия с водородом образуется гидрид натрия.

Активные металлы бурно реагируют с водой при комнатной температуре.

При повышенной температуре с водой реагируют и менее активные металлы.

Металлы, стоящие в ряду активности до водорода, реагируют с кислотами (кроме HNO3 любой концентрации и H2SO4 концентрированной) с образованием солей и водорода.
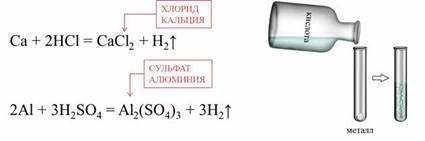
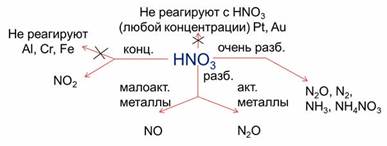
В азотной кислоте растворяются металлы, стоящие и до, и после водорода. При этом образуются нитраты, а также различные продукты восстановления азотной кислоты.
 2020-06-12
2020-06-12 161
161






