Химически чистая вода является очень слабым электролитом, и лишь в незначительной степени диссоциирует на ионы в соответствии с уравнением:
Н2О ⇄Н++ OH–
Процесс электролитической диссоциации воды, как и любого слабого электролита, может быть охарактеризован константой диссоциации:

Столь малое значение константы диссоциации воды свидетельствует о ничтожно малой концентрации водородных ионов и гидроксид-ионов в воде, т. е. о том, что вода является очень слабым электролитом. По данным измерения электропроводности химически чистой воды концентрация продиссоциировавших молекул воды составляет 10-7моль/л. Пренебрегая этой величиной, можно считать концентрацию недиссоциированных молекул воды величиной постоянной и равной  моль/л.
моль/л.
Таким образом, произведение концентраций водородных ионов и гидроксид-ионов также является величиной постоянной и называется ионным произведением воды (Кн2о);
 моль2/л2
моль2/л2
Указанные значения константы диссоциации и ионного произведения воды соответствуют температуре 22° С. Так как процесс диссоциации воды является эндотермическим, то при повышении температуры равновесие реакции смещается вправо, т. е. в сторону образования ионов, и, следовательно, константа диссоциации и ионное произведение воды с повышением температуры увеличиваются. Так, при 100°С ионное произведение воды имеет значение  .
.
Таким образом, в любых водных растворах концентрации ионов Н+ и OH– связаны между собой значением Кн2о.
Согласно теории электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОН- основных свойств. Поэтому раствор будет нейтральным, когда их концентрации будут равны, а именно:
 моль/л.
моль/л.
Если концентрация водородных ионов больше концентрации гидроксид-ионов, т. е.  и
и  моль/л, то реакция среды кислая. Для щелочных растворов концентрация водородных ионов меньше концентрации гидроксид-ионов, т. е.
моль/л, то реакция среды кислая. Для щелочных растворов концентрация водородных ионов меньше концентрации гидроксид-ионов, т. е.  и
и  моль/л.
моль/л.
Таким образом, величина концентрации водородных ионов указывает на характер среды:
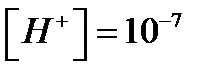 моль/л нейтральная среда;
моль/л нейтральная среда;
 моль/л кислая среда;
моль/л кислая среда;
 моль/л щелочная среда.
моль/л щелочная среда.
Обычно кислотность или щелочность раствора выражают не концентрацией водородных ионов, а величиной ее отрицательного десятичного логарифма. Эта величина называется водородным показателем раствора (рН):
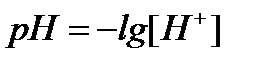 .
.
В зависимости от кислотно-основного характера раствора водородный показатель имеет следующие значения:
нейтральная среда -  ;
;
кислая среда -  ;
;
щелочная среда -  .
.
Чем меньше значение рН, тем больше кислотность среды; чем больше значение рН, тем больше щелочность среды.
В некоторых случаях пользуются гидроксидным показателем

Логарифмируя выражение  получают зависимость между водородным и гидроксидным показателями:
получают зависимость между водородным и гидроксидным показателями: 
Зная молярную концентрацию раствора кислоты или основания, т. е. концентрации водородных и гидроксид-ионов соответственно, можно вычислить водородный показатель раствора и, наоборот, по значению рН вычислить концентрацию ионов Н+ или OH–.
Пример 1. Вычислить значение рН 0,1 молярного раствора НСl. Определить среду.
Для данного раствора кислоты концентрация ионов водорода также равна 0,1 моль/л (10‒1 моль/л). Следовательно, водородный показатель данного раствора

Среда кислая.
Пример 2. Вычислить водородный показатель 0,1 молярного раствора NaOH. Определить среду.
Для данного раствора
[OH–] = 0,1 моль/л (10–1 моль/л), следовательно,
 моль/л,
моль/л,
а значение 
Среда щелочная.
Водородный показатель имеет важное значение для понимания химических и биологических процессов, протекающих в природных водах. От величины рН зависит развитие и жизнедеятельность водных растений, степень агрессивности воды по отношению к металлам, бетону. Значение рН морской воды изменяется в пределах от 7,7 до 8,4.
Для приблизительного определения рН пользуются индикаторами, т.е. веществами, изменяющими окраску раствора в зависимости от кислотности среды. Наиболее распространенные индикаторы - лакмус, фенолфталеин, метиловый оранжевый. Изменение окраски индикаторов происходит при определенных значениях рН. Для установления кислотности среды в широком диапазоне изменения рН пользуются универсальным индикатором.
Для более точного определения используют приборы рН–метры. Использование специального прибора — pH–метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов.
Контрольные вопросы
1. Что такое растворы? Приведите примеры истинных растворов.
2. Какой компонент раствора является растворителем?
3. При какой температуре замерзает раствор, полученный при растворении 9,2 г глицерина С3Н8О3 в 100 г воды?
4. В чем заключается второй закон Рауля? Для растворов каких веществ он выполняется и почему?
5. Что такое давление насыщенного пара раствора?
6. Что такое осмос, приведите примеры осмотических ячеек.
7. Какие вещества называются электролитами? Приведите примеры.
8. В чем заключается механизм электролитической диссоциации?
9. Закончите уравнения реакций в молекулярном виде, напишите ионные уравнения этих реакций:
а) NH4NO3 + KOH®
б) AgNO3 + AlBr3 ®
в) NH4OH + HCl®
10. Вычислите pH и pOH
а) раствора HCl c концентрацией 0,01 моль/л;
б) раствора KOH c концентрацией 0,1 моль/л.
 2020-06-10
2020-06-10 144
144








