Существует большая группа растений (>500 видов покрытосеменных), у которых первичными продуктами фиксации СО2 и восстановления являются четырехуглеродные соединения. Их называют С4-растениями. Основы для биохимического исследования фотосинтеза у _С4-растений были заложены в работах Л. А. Незговоровой (1956-1957), К. С. Карпилова и И. А. Тарчевского (1960-1963). В 1966 г. Хетч и Слэк (австрал.) предложили законченную схему цикла темповых реакций у С4-растений, которая получила название цикла Хетча и Слэка.
К С4-растениям относится ряд культурных растений преимуественно тропического и субтропического происхождения: кукуруза, просо, сорго, сахарный тростник и многие злостные сорняки - свинорой, сыть округлая, ежовник крестьянский, просо куриное, просо крупное, гумай (сорго алепское), щирица, щетинник и др. Как правило, это высокопродуктивные растения, устойчиво осуществляющие фотосинтез при значительных повышениях температуры и в засушливых условиях.
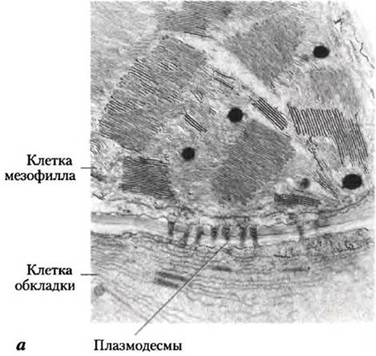
Для листьев С4-растений характерно анатомическое строение кранц-типа (от нем. Kranz - венок, корона), т. е. наличие явно отличающихся друг от друга фотосинтезирующих клеток двух типов, которые располагаются концентрическими кругами: радиально расположенные вокруг проводящих пучков клетки обкладки и основной мезофилл.
Клетки обкладки проводящего пучка содержат крупные, лишенные гран (агранальные) хлоропласты. В клетках мезофилла находятся более мелкие гранальные хлоропласты. Эти два типа клеток физиологически не равноценны и специализируются на выполнении разных звеньев фотосинтеза.
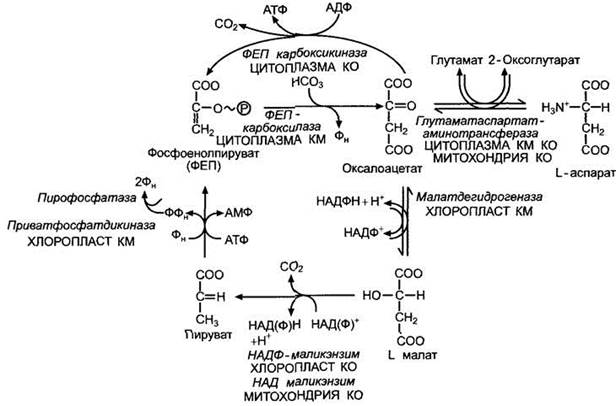
C4-цикл можно разделить на две стадии: карбоксилирование (в клетках мезофилла) и декарбоксилирование и синтез углеводов (в клетках обкладки проводящих пучков). Общим для всех С4-растений является то, что карбоксилированию подвергается фосфоенолпировиноградная кислота (ФЕП) при участии ФЕП-карбоксилазы и образуется щавелевоуксусная кислота (ЩУК), которая восстанавливается до яблочной кислоты или аминируется с образованием аспарагиновой кислоты.
ЩУК, яблочкая и аспарагиновая кислоты являются C4 соединениями.
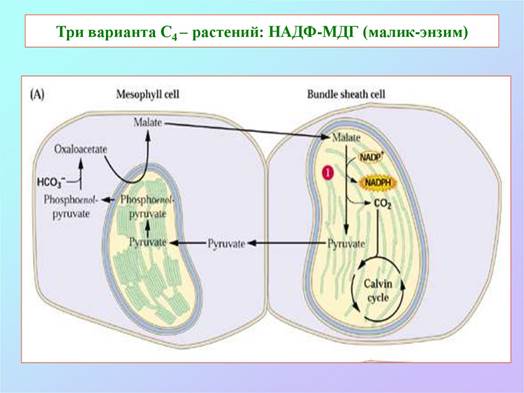
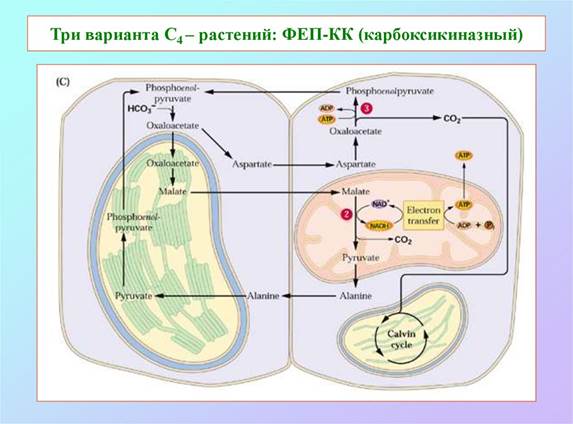
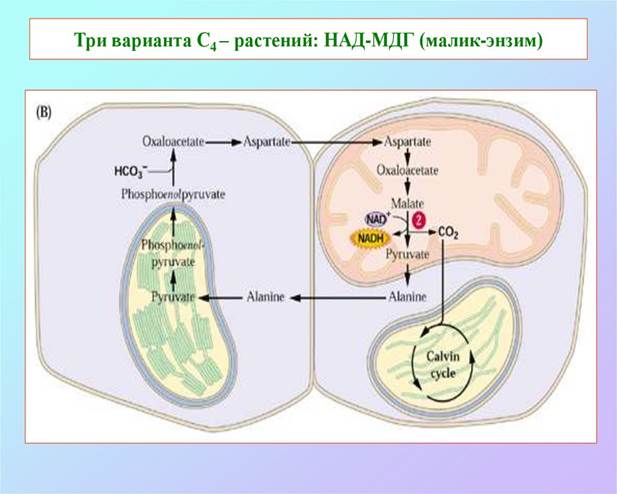
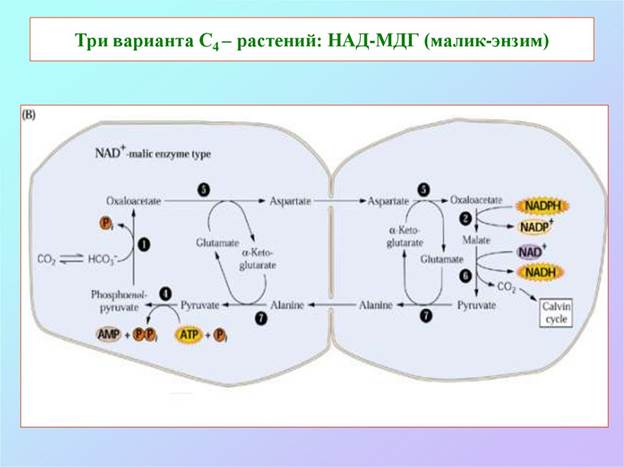
По способу декарбоксилирования при участии НАДФ-Н или НАД-малатдегидрогеназы (МДГ), называемой также малик-энзимом и яблочным ферментом) или ФЭП-карбоксикиназы (ФЕП-КК) у С4-растений можно выделить три группы: НАДФ-МДГ, НАД-МДГ и ФЕП-КК-типы соответственно.
У НАДФ-МДГ-растений главными метаболитами, вовлеченными в обмен между клетками, являются малати пируват (ПВК), у НАД-МДГ-растений - аспартат и аланин и у ФЕП-КК-растений - аспартат и ФЕП.
Важнейшие с-х культуры (кукуруза, сорго, сахарный тростник) и такие сорняки, как сыть, ежовник, щетинник, гумай относятся к НАДФ-МДГ-типу.
Рассмотрим С4-цикл восстановления СО2 на примере этих растений.
СО2, поступающий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбоксилазы вступает в реакцию с ФЕП, образуя ЩУК (оксалоацетат).
Затем в хлоропластах ЩУК восстанавливается до яблочной кислоты (малата) за счет НАДФúН, образующегося в ходе световой фазы фотосинтеза; ЩУК в присутствии NH4 может превращаться также в аспартат.
Опыты с радиоактивной меткой (14С) показали, что после освещения растений в течение 1 с более 90 % радиоактивности обнаруживается в составе С4-кислот.
Затем малат переносится в хлоропласты клеток обкладки сосудистого пучка, где он подвергается окислительному декарбоксилированию, продуктом которого является ПВК. Последняя снова диффундирует в мезофилл, где при участии АТФ, образованной в световой фазе, происходит регенерация ФЕП, после чего цикл карбоксилирования повторяется с участием новой молекулы СО2. Образовавшиеся в результате окислительного декарбоксилирования малата СО2 и НАДФ-Н поступают в цикл Кальвина, что приводит к образованию ФГК и других продуктов, свойственных С3-растениям. Следовательно, именно клетки обкладки выполняют роль основной ассимилирующей ткани, поставляющей сахара в проводящую систему. Клетки мезофилла выполняют вспомогательную функцию - подкачку СО2 для цикла Кальвина.
Таким образом, С4-путь обеспечивает более полное усвоение СО2, что особенно важно для тропических растений, где основным лимитирующим фактором фотосинтеза является концентрация СО2. Эффективность усвоения СО2 С4-растениями увеличивается также за счет подачи НАДФ-Н в хлоропласты клеток обкладки. Эти хлоропласты имеют агранальное строение и специализируются на темповой фазе фотосинтеза, здесь практически не происходит НЦФФ. На один агранальный хлоропласт в среднем приходится 8-10 гранальных хлоропластов, осуществляющих первичную фиксацию СО2 и НЦФФ. Такая компартментация процессов и кооперация функционирования тканей обеспечивают повышение продуктивности растений и позволяют накапливать СО2 в органических кислотах для осуществления фотосинтеза даже при закрытых устьицах в наиболее жаркое время дня. Это сокращает потери воды на транспирацию. Эффективность использования воды С4-растениями вдвое выше, чем у С3-растений.
С4-растений фиксация СO2 и активность рубиско пространственно разделены
С4-Растения обычно развиваются при большой интенсивности света и высокой температуре. Их отличает несколько важных характеристик: высокая скорость фотосинтеза, большая скорость роста, низкий уровень фотодыхания, малая скорость потери влаги и специализированная структура листа.
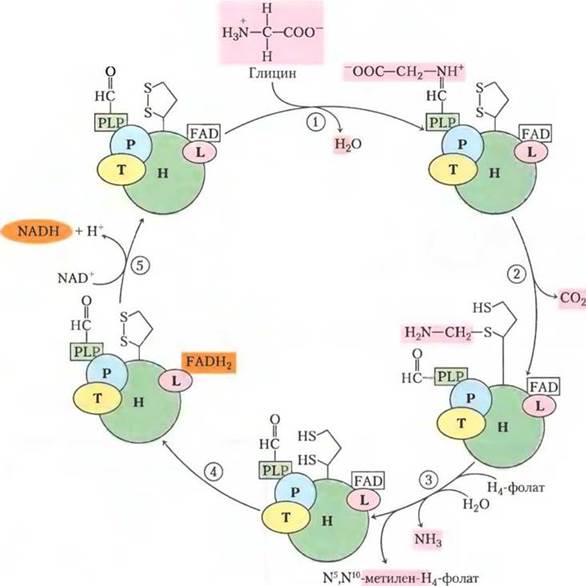
Глициндекарбоксилазная система. Глициндекарбоксилаза митохондрий растений представляет собой комплекс из четырех типов субъединиц со стехиометрией
P4H27T9L2. С белком Н ковалентно связан остаток липоевой кислоты, которая может подвергаться обратимому окислению. (1) — образование шиффова основания между пиридоксальфосфатом (PLP от англ. pyridoxal phosphate) и глицином, катализируемое белком Р (названным так потому, что он образует связь с PLP). (2) — белок Р катализирует окислительное декарбоксилирование глицина, высвобождая СО2; оставшаяся группа метиламина связана с одной из -SH-групп восстановленной липоевой кислоты. (3) — белок Т (который использует тетрагидрофолат (H4F) в качестве кофактора) высвобождает NH3 из метиламина и переносит оставшийся одноуглеродный фрагмент на тетрагидрофолат, образуя N5, N10-метилентетрагидрофолат. (4) — белок L окисляет две -SH- группы липоевой кислоты до дисульфидной связи, (5) передавая электроны через FAD на NAD+ и завершая таким образом цикл. N5, N10-Метилентетрагидрофолат, образованный в этом процессе, используется серин-гидроксиметилтрансферазой для превращения молекулы глицина в серин, в результате регенерируется тетрагидрофолат, необходимый для реакции, катализируемой белком Т. L-Субъединица глициндекарбоксилазы идентична дигидролипоилдегидрогеназе (Е3) пируватдегидрогеназы и α-кетоглутаратдегидрогеназы
У тропических растений первый интермедиат, в который включается 14СО2, — четырехуглеродное соединение оксалоацетат. Эта реакция происходит в цитозоле клеток мезофилла листьев и катализируется фосфоенолпируват- карбоксилазой, субстратом для которой служит НСО3-, а не СО2. Затем оксалоацетат либо восстанавливается до малата с расходом NADPH (см. рис. 20-26, б), либо превращается в аспартат в реакции трансаминирования:
Оксалоацетат + α-аминокислота —> L-аспартат + α-кетокислота
Малат или аспартат, синтезированный в клетках мезофилла, проникает в соседние клетки обкладки через плазмодесмы — образованные белками каналы, которые соединяют две растительные клетки и осуществляют движение метаболитов и даже малых белков между клетками. В клетках обкладки малат окисляется и декарбоксил ируется с образованием пирувата и СО2 под действием NADP-зависимой декарбоксилирующей малатдегидрогеназы (иногда называемой малик-ферментом, или яблочным ферментом) с восстановлением NADP+. У растений, использующих аспартат в качестве переносчика СО2, аспартат, поступивший в клетки обкладки, трансаминируется с образованием оксалоацетата и восстанавливается до малата, после чего СО2 высвобождается малатдегидро- геназой или ФЕП-карбоксикиназой. Как показали эксперименты с образцами, меченными 14С, молекула СО2, высвобождающаяся в клетках обкладки, — это та же самая молекула СО2, которая изначально находилась в оксалоаце- тате в клетках мезофилла. Эта молекула СО2 снова фиксируется, теперь с помощью рубиско, в той же самой реакции, которая происходит у С3-растениях: происходит включение СО2в положение С-1 молекулы 3-фосфоглицерата.
Пируват, образовавшийся при декарбокси- лировании малата в клетках обкладки, транспортируется обратно, в клетки мезофилла, где превращается в фосфоенолпируват в необычной реакции, катализируемой пируват-фосфатдикиназой (рис. б). Этот фермент называется дикиназой, потому что он, используя одну молекулу АТР, одновременно фосфорилирует две разные молекулы: пируват до фосфоенолпирувата и фосфат до пирофосфата. Впоследствии пирофосфат гидролизуется до фосфата, поэтому получается, что для регенерации фосфоенолпирувата используются две высокоэнергетические фосфатные группы АТР. Теперь этот фосфоенолпируват готов для включения следующей молекулы СО2 в клетки мезофилла.
А)Ассимиляция углерода у С4-растений. В растениях тропических районов преобладает С4-путъ, проходящий в клетках мезофилла и клетках обкладки, а — электронная микрофотография, показывающая хлоропласта мезофилла и прилегающих клеток обкладки. Клетки обкладки содержат гранулы крахмала. Видны плазмодесмы, соединяющие две клетки. Б) — С4-путь ассимиляции СO2, который происходит с участием четырехуглеродного интермедиата.
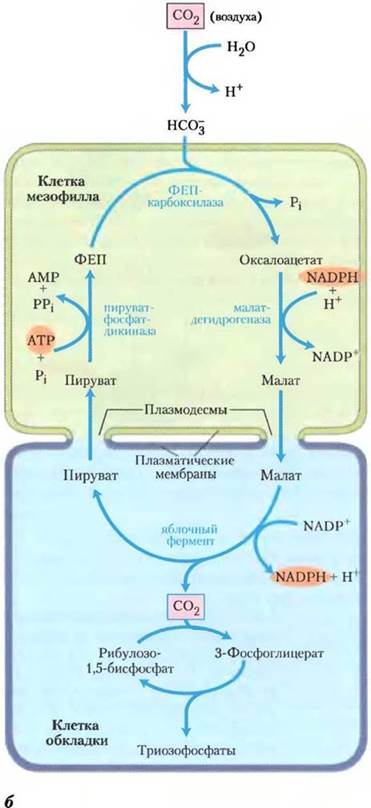
ФЕП-карбоксилаза имеет высокое сродство к НСО3- (который в водном окружении образуется из СО2) и фиксирует СО2 более эффективно, чем рубиско. В отличие от рубиско этот фермент не использует О2 в качестве альтернативного субстрата, поэтому в этой реакции нет конкуренции между СО2 и О2. Таким образом, ФЕП- карбоксилазная реакция служит для фиксации СО2 в форме малата. Высвобождением СО2 из малата в клетках обкладки достигается высокая локальная концентрация углекислого газа для функционирования рубиско с почти максимальной скоростью и подавления ее оксигеназной активности.
В клетках обкладки СО2 включается в 3-фосфоглицерат, поэтому другие реакции цикла Кальвина происходят так, как было описано ранее. Таким образом, у С4-растений клетки мезофилла осуществляют ассимиляцию СО2 по С4- пути, а клетки обкладки синтезируют крахмал и сахарозу по С3-пути.
В С4-пути три фермента, которые регулируются светом, становятся более активными в дневное время суток. Малатдегидрогеназа активируется через тиоредоксин-зависимый восстановительный механизм; ФЕП-карбоксилаза активируется фосфорилированием серинового остатка; а пируват-фосфатдикиназа активируется дефосфорилированием. В последних двух случаях детали инициации светом процессов фосфорилирования или дефосфорилирования неизвестны.
У С4-растений путь ассимиляции СО2 энергетически более дорогой, чем у С3-растений. На каждую молекулу СО2, ассимилированную в С4- пути, должна регенерироваться молекула ФЕП с затратой двух высокоэнергетических фосфатных групп АТР. Таким образом, С4-растениям необходимо пять молекул АТР на ассимиляцию одной молекулы СО2, в то время как С3-растениям надо только три молекулы АТР (девять АТР на один триозофосфат). Однако при увеличении температуры (и уменьшении сродства рубиско к СО2, как было замечено ранее) достигаются условия (около 28-30 °С), при которых выгода устранения фотодыхания значительно превосходит энергетические траты. С4-Растения (например, сорняк росичка кровяная) в течение лета обгоняет в росте большинство С3-растений, что может подтвердить любой опытный садовод.
 2020-06-08
2020-06-08 3705
3705