Стр. 96-99 9 класс
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, — например, при охлаждении, — медленно; при этом различие в скорости одной и той же реакции может быть очень большим.
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Гомогенной называется система, состоящая из одной фазы, гетерогенной — система, состоящая из нескольких фаз.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге). Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции заединицу времени в единице объема системы.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции заединицу времени на единице площади поверхности фазы.
Например для реакции:
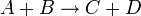
выражение для скорости будет выглядеть так:
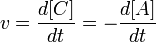 .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ;
· наличие катализатора;
· температура (правило Вант-Гоффа);
· давление;
· площадь поверхности реагирующих веществ.
 2020-07-12
2020-07-12 86
86








