Установка нормальности раствора NaOH по щавелевой кислоте.
1. Приготовление 1000 мл щёлочи приближённой 0,1 н. (нормальная концентрация). Рассчитайте количество щёлочи (NaOH) в г. При расчётах используют нормальную концентрацию растворов
нормальная N =  ;
;
Грамм – эквивалент Э (г-экв) – это количество вещества в граммах, эквивалентное одному атому или иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Э кислоты =  ; Э соли =
; Э соли = 
* Э основания = 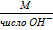 Э (NaOH) =
Э (NaOH) =  =...... (рассчитать)
=...... (рассчитать)
* m(в) = 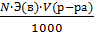 ; m(в) =..... (рассчитать)
; m(в) =..... (рассчитать)
Необходимо брать на 1 г больше. Едкие щёлочи жадно поглощают из воздуха влагу и углекислый газ.
2. Приготовление 250мл точно 0,1н раствора щавелевой кислоты (Н2С2О4• 2Н2О). Рассчитайте количество кислоты.
* Э кислоты =  =126,0: 2=... (разделить)
=126,0: 2=... (разделить)
* m(в) = 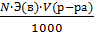 ; m(в) =..... (рассчитать)
; m(в) =..... (рассчитать)
Вычисленную навеску возьмите на аналитических весах на часовом стекле и через воронку без потерь перенесите в мерную колбу, тщательно смойте с часового стекла и воронки оставшиеся кристаллики кислоты дистиллированной водой в ту же колбу, перемешайте до растворения, долейте до метки.
3. Титрование. Прежде чем приступить к титрованию следует подобрать индикатор. Титровать будете слабую кислоту сильной щёлочью.
H2C2O4+2NaOH=Na2C2O4+2H2O
Вследствие гидролиза образовавшейся соли при реакции нейтрализации в момент эквивалентности среда будет щелочная. Поэтому индикатор *(какой?) .....
Тщательно вымытую бюретку сполосните рабочим раствором щёлочи и им же заполните её, следите, чтобы и капилляр бюретки был заполнен раствором. Установите мениск на нулевом делении бюретки, держа глаз на уровне мениска.
В чистую коническую колбу внесите 2 мл раствора кислоты, добавьте 1 каплю индикатора 1%-ного раствора и начинайте титровать - приливать в колбу с щавелевой кислотой понемногу раствор щёлочи из бюретки, непрерывно размешивая жидкость в колбе плавным движением. Титруйте до устойчивого розово-малинового цвета от одной капли. Повторите три раза. Данные запишите в таблицу. Рассчитайте по среднему значению объёма.
|
№ титрования
|
Раствор щавелевой кислоты |
Раствор щёлочи | ||||
| V1 (мл) | N1 | V2 (мл) | N2 | |||
| 1. | 2 | 0,1 | 1,8 | V1∙ N 1= V 2∙N1 * V2=.... | ||
| 2. | 2 | 0,1 | 1,7 | |||
| 3. | 2 | 0,1 | 1,9 | |||
| Среднее значение объёма раствора щёлочи | *.... | |||||
|
| ||||||
В основа расчёта -закон эквивалентов: отношение объёмов реагирующих веществ обратно пропорционально их нормальностям.
Отчёт сдать. (записать кратко, * чётко, дополнительно тест)
 2020-06-29
2020-06-29 520
520






