Практическая занятие № 9
Химические свойства углеводов
Раздел 2. Органическая химия
Тема 2.9 Углеводы.
Цель занятия:
1. Изучить химические свойства глюкозы, сахарозы и крахмала.
2. Решить качественные задачи на распознание органических веществ.
3. Выполнить упражнения по теме: Углеводы.
Цель работы. Практически изучить свойства глюкозы, сахарозы и крахмала
Задание:
1. Прочитать теоретическую справку, главы в учебнике (§18.1-§18.3 стр.284-295 Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений)
2. Посмотреть видеоматериал по экспериментам.
3. Выполнить задание по практической работе.
4. Оформить отчет в соответствии с заданием (указать название работы, цель, приборы и реактивы, ход выполнения, заполнить таблицу, сформулировать вывод по работе).
5. Ответить письменно на вопросы.
6. Материалы в форме фотоотчета отправить по электронной почте не позднее даты, указанной в информационной карте.
Теоретическая справка.
Углеводы широко распространены в природе и играют большую роль в биологических процессах живых организмов и человека.
Углеводы в зависимости от их строения можно подразделить на моносахариды, дисахариды и полисахариды.
Важнейшим из моносахаридов является глюкоза С6Н1206,. Она принадлежит к гексозам, так как в её молекуле содержится 6-ть атомов углерода, а так же является альдегидоспиртом, потому что содержит 1-у альдегидную и 5-ть гидроксильных групп.
Химические свойства глюкозы обусловлены наличием в молекуле альдегидной и гидроксильных групп.
Как и альдегиды, глюкоза реагирует:
1) с оксидом серебра (I) в аммиачном растворе (реакция «серебряного зеркала»):



 О О
О О

 СН2ОН(СНОН)4─С + Аg2O →
СН2ОН(СНОН)4─С + Аg2O →  СН2ОН(СНОН)4─С + 2 Аg ↓
СН2ОН(СНОН)4─С + 2 Аg ↓
Н ОН
Глюконовая кислота
2) с гидроксидом меди (II) Сu(ОН)2



 О О
О О

 СН2ОН(СНОН)4─С + Сu(ОН)2 →
СН2ОН(СНОН)4─С + Сu(ОН)2 →  СН2ОН(СНОН)4─С + Cu2O ↓ +Н2О
СН2ОН(СНОН)4─С + Cu2O ↓ +Н2О
Н ОН
Глюконовая кислота
Как и спирты, глюкоза реагирует:
1) с гидроксидом меди (II) Сu(ОН)2
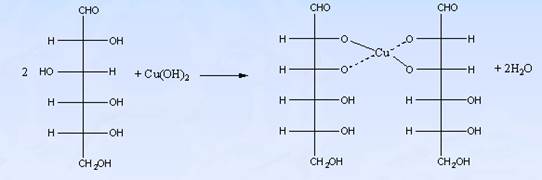
глюконат меди
Наибольшее значение из дисахаридов имеет сахароза.
Сахароза не даёт реакций, свойственных моносахаридам, так отсутствуют свободные альдегидная и кетонная группа, но легко гидролизуется с образованием глюкозы и фруктозы (в кислой среде – Н2SO4; t):
C12H22O11 + H2O → C6H12O6 + C6H12O6.
Простейшим представителем полисахаридов является крахмал. Химическая формула крахмала (С6Н1005)n, где n - достигает нескольких тысяч.
Характерной реакцией крахмала является его взаимодействие с иодом. Если к охлаждённому крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь. Этим свойством пользовались при определении крахмала в пищевых продуктах.
Крахмал сравнительно легко подвергается гидролизу:
H+, t
(C6H10O5)n + nH2O → nC6H12O6
В зависимости от условий гидролиз крахмала может протекать ступенчато, с образованием различных промежуточных продуктов:
(C6H10O5)n → (C6H10O5)m → C12H22O11 → nC6H12O6
крахмал декстрины мальтоза глюкоза
(изомер сахарозы)
 2020-06-29
2020-06-29 72
72







