· Формулы расчета титра
Тр.р = 
Тр.р/о.в = 
Тр.р/о.в = 
Пример 2.
Для установки точной концентрации раствора хлороводородной кислоты масса навески соды 5.2060г растворена в мерной колбе объемом 500 мл. На титрование 25 мл полученного раствора расходуется 26.18 мл раствора кислоты. Рассчитать молярную концентрацию эквивалента HCl, титр, титр по гидроксиду натрия
Дано:
m Na2CO3=5.2060г
Vр =500мл
V Na2CO3 =25мл
V HCl =26.18мл
Найти:
С(1/1HCl)-?
Т HCl-?
Т HCl/ NaOH-?
Рассчитываем концентрацию раствора соды
М Na2CO3=286.14г/моль
М(1/2 Na2CO3)=143.07г/моль
C(1/2 Na2CO3) =  =
=  = 0.07моль/л
= 0.07моль/л
М HCl=36.46г/моль М NaOH= 40г/моль
С(1/1HCl) =  =
=  моль/л
моль/л
Т HCl =  =
=  =0.002534г/мл
=0.002534г/мл
Т HCl / NaOH = 
 =
=  = 0.00278г/мл
= 0.00278г/мл
Ответ: С(1/1HCl)  моль/л; Т HCl=0.002534г/мл; Т HCl / NaOH =0.00278г/мл
моль/л; Т HCl=0.002534г/мл; Т HCl / NaOH =0.00278г/мл
· Расчёт результата анализа.
Рассмотрим расчет на конкретном примере
Пример 1.
Масса навески технической соды 1,2212г растворена в воде и объем доведен до 250мл в мерной колбе. На титрование 25мл полученного раствора расходуется 23,05мл HCl с молярной концентрацией эквивалента 0,0985моль/л. Определить массовую долю карбоната натрия.
Дано:
mн = 1.2212г
Vр= 250мл
VaNa2CO3 = 25мл
VHCl = 23,05мл
С(1/1 HCl) = 0.0985моль/л
Найти:
W%Na2CO3 -?
Решение:
W%Na2CO3 =  *100
*100
Из формулы молярной концентрации эквивалента выразим массу растворенного карбоната натрия.
mNa2CO3 = C (1/2 Na2CO3) *M(1/2 Na2CO3) *V
Неизвестную концентрацию рассчитаем по результатам титрования.
C (1/2 Na2CO3)  =
= 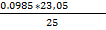 = 0.0908 моль/л
= 0.0908 моль/л
mNa2CO3=0.0908*53*0.25=1.2030г

Проанализировав весь расчёт, можно вывести общую формулу для расчётов:
W%= 
где:
W%- массовая доля определяемого компонента, %
С(fэкв.р.р) – молярная концентрация эквивалента рабочего раствора, моль/л
М(fэкв.о.в) – молярная масса эквивалента определяемого вещества, г/моль
Vр – объём мерной колбы для разведения навески, мл
Vа – объём аликвотной части анализируемого раствора, взятой для титрования, мл
Vр.р – объём рабочего раствора, пошедшего на титрование, мл
mн – масса навески, г
В формуле выделим:
Тр.р/о.в = 
Формула для расчётов примет вид:
W%= 
где:
 - титр рабочего раствора по определяемому веществу
- титр рабочего раствора по определяемому веществу
Для метода отдельных навесок формула имеет вид:
W%= 
Пример 2. Вычисление результатов при использовании способа пипетирования.
В мерную колбу вместимостью 100 мл перенесли 0,6504 г технической щавелевой кислоты, растворили и довели объем раствора водой до метки. Пипеткой (мерной) брали по 10,00 мл полученного раствора и титровали 0,1026 н. раствором гидроксида натрия, расход которого составил в среднем 9,85 мл. Определите массовую долю (%) Н2С2О4·2Н2О в щавелевой кислоте.
Дано:
mн=0,6504 г
Vр=100 мл
Vа=10, 00 мл
С(1/1 NaOH) =0,1026моль/л
Vр.р=9,85 мл
W%(Н2С2О4·2Н2О) =?
Решение.
М(1/2Н2С2О4·2Н2О) =1/2*126.07=63.035г/моль
Т NaOH / Н2С2О4·2Н2О =  =
=  = 0.006468г/мл
= 0.006468г/мл
W%(Н2С2О4·2Н2О) =  =
=
=  = 97,95%
= 97,95%
Ответ: массовая доля щавелевой кислоты равна W% (Н2С2О4·2Н2О) = 97,95%
Пример 3. Вычисление результатов при использовании способа отдельных навесок.
Рассчитать массовую долю (%) Н2С2О4·2Н2О в образце технической щавелевой кислоты, если на титрование 0,1500 г его пошло 25,60 мл 0,09002 н. раствора NaOH?
Дано:
mн=0,1500 г Vр=100 мл
С(1/1 NaOH) = 0,09002 моль/л
Vр.р= 25,60 мл
W%(Н2С2О4·2Н2О) =?
Решение.
М(1/2Н2С2О4·2Н2О) =1/2*126.07=63.035г/моль
Т NaOH / Н2С2О4·2Н2О =  =
=  = 0.005674г/мл
= 0.005674г/мл
W%(Н2С2О4·2Н2О) =  =
=
=  = 96.83%
= 96.83%
Ответ: массовая доля щавелевой кислоты равна W% (Н2С2О4·2Н2О) = 96.83%
 2020-06-29
2020-06-29 103
103







