Кривая потенциометрического титрования - графическое изображение изменения ЭДС электрохимической ячейки в зависимости от объема прибавленного титранта.
Кривые потенциометрического титрования строят в различных координатах:
• кривые титрования в координатах  , иногда такие кривые называют интегральными кривыми титрования;
, иногда такие кривые называют интегральными кривыми титрования;
• дифференциальные кривые титрования - в координатах
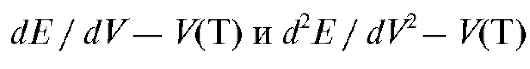
• кривые титрования по методу Грана - в координатах
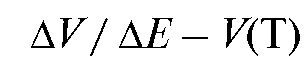
где  - ЭДС потенциометрической ячейки,
- ЭДС потенциометрической ячейки,  - объем прибавленно-
- объем прибавленно-
го титранта,  - изменение потенциала, соответствующее прибавлению
- изменение потенциала, соответствующее прибавлению  титранта.
титранта.
На рис. 3-8 приведены схематически различные типы кривых потенциометрического титрования.
По построенным кривым титрования определяют объем титранта
 в ТЭ, как это показано на рис. 3-8. Объем титранта
в ТЭ, как это показано на рис. 3-8. Объем титранта  прибавленного в ТЭ, можно определить
прибавленного в ТЭ, можно определить
не только графически, но и расчетным путем по формуле (18):
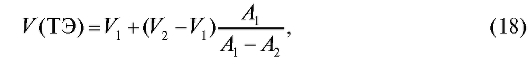
где 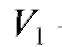 - объем прибавленного титранта, соответствующий последнему измерению до ТЭ;
- объем прибавленного титранта, соответствующий последнему измерению до ТЭ;  - объем прибавленного титранта, соответствующий первому измерению после ТЭ;
- объем прибавленного титранта, соответствующий первому измерению после ТЭ;


Рис. 3-8. Типы кривых потенциометрического титрования (Е - измеряемая ЭДС,  - объем прибавленного титранта,
- объем прибавленного титранта,  - объем титранта, при-
- объем титранта, при-
бавленного в точке эквивалентности): а - кривая титрования в координатах  ; б, в - дифференциальные кривые титрования; г - кривая титрования по методу Грана
; б, в - дифференциальные кривые титрования; г - кривая титрования по методу Грана
В таблице 3-9 в качестве примера (фармакопейного) приведены результаты определений и расчетов при потенциометрическом титровании.
Рассчитаем по формуле (18) величину V (ТЭ) с использованием данных табл. 3-9. Очевидно, что максимальное значение 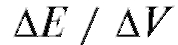 = 1000. Следовательно,
= 1000. Следовательно,  = 5,20 и
= 5,20 и 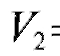 = 5,30;
= 5,30;  = 720,.
= 720,. 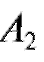 = -450. Отсюда:
= -450. Отсюда:

Таблица 3-9. Пример обработки результатов потенциометрического титрования

Применение потенциометрического титрования. Метод - универсальный, его можно применять для индикации конца титрования во всех типах титрования: кислотно-основном, окислительновосстановительном, комплексиметрическом, осадительном, при титровании в неводных средах. В качестве индикаторных используют стеклянный, ртутный, ион-селективные, платиновый, серебряный электроды, а в качестве электродов сравнения - каломельный, хлорсеребряный, стеклянный.
Метод обладает высокой точностью, большой чувствительностью; позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе, например, раздельно определять хлорид- и иодид-ионы при аргентометрическом титровании.
Методами потенциометрического титрования анализируют многие лекарственные вещества, например, аскорбиновую кислоту, сульфамидные препараты, барбитураты, алкалоиды и др.
 2020-06-29
2020-06-29 137
137







