Изомерия
Для аминокислот характерны следующие виды изомерии: углеродного скелета, положения функциональных групп и оптическая изомерия.
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества, хорошо растворимые в воде. Они плавятся при высоких температурах с разложением.
Получение
Аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах. В общем виде уравнение реакции будет выглядеть так:
R-CH(Cl)-COOH + NH3 → R-CH(NH3+Cl—) → NH2–CH(R)-COOH
Химические свойства аминокислот. Для аминокислот характерны все химические свойства карбоновых кислот (по карбоксильной группе) с основаниями:
NH2–CH2-COOH + NaOH → NH2–CH2-COONa + H2O
и аминов (по аминогруппе) с кислотами: NH2–CH2-COOH + HCl → Cl[NH3–CH2-COOH]
Аминокислоты – амфотерные соединения. Они реагируют как с кислотами, так и с основаниями:
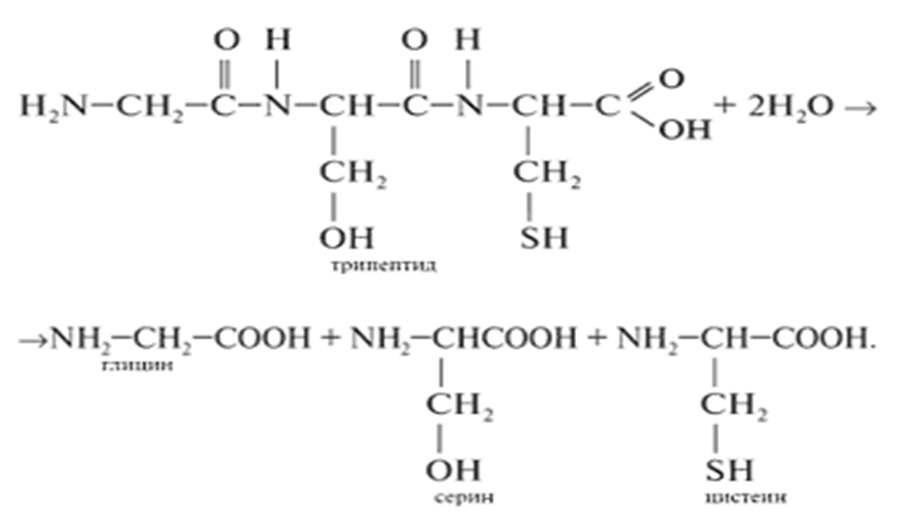
Молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:

Полученное соединение называют дипептидом. Вещества, построенные из многих остатков аминокислот, называются полипептидами. Пептиды гидролизуются под действием кислот и оснований.
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями:
H2N –CH2-COOH ↔ +H3N-CH2COO—
Молекулу внутренней соли называют биполярным ионом.
Водные растворы аминокислот имеют нейтральную, щелочную и кислотную среду в зависимости от количества функциональных групп. Например, глутаминовая кислота образует кислый раствор, поскольку в её составе две карбоксильные группы и одна аминогруппа, а лизин – щелочной раствор, т.к. в её составе одна карбоксильная группа и две аминогруппы.
α-Аминокислоты играют особую роль в природе, поскольку при их совместной поликонденсации в природных условиях образуются важнейшие для жизни вещества – белки.
Белки — высокомолекулярные органические вещества, состоящие из альфа- аминокислот, соединённых в цепочку пептидной связью. В состав большинства природных белков входит около 20 α-аминокислот.

Физические свойства: Классификация белков – простые белки (протеины) и сложные (протеиды)
В состав белков входят химические элементы C, H, O, N, S. Ферментные белки часто содержат P (казеин молока), Fe (гемоглобин), Cu, Zn.
Структуры белка.
Первичная структура – последовательность чередования аминокислотных остатков в полипептидной цепи.
Вторичная структура – пространственная конфигурация полипептидной цепи в виде спирали, за счет образования водородных связей между близко расположенными аминокислотными остатками с помощью водородных связей.
Третичная структура – трехмерная конфигурация, которую принимает в пространстве закрученная спираль, имеет форму шара (глобулы). Образуется за счет взаимодействия радикалов аминокислот при помощи дисульфидных связей, а также ковалентных (сложноэфирных и солевых мостиков) и водородных связей. Третичной структурой объясняется специфичность белковой молекулы и ее биологическая активность.
Четвертичная структура – расположение в пространстве нескольких полипептидных цепей, каждая из которых имеет свою первичную, вторичную и третичную структуру и называется субъединицей. Объединение с помощью водородных ионных, гидрофобных связей. В эту структуру белка могут быть включены и небелковые компоненты.
Химические свойства белков
1. Гидролиз (кислотно-основный, ферментативный), в результате которого образуются аминокислоты.
2. Денатурация – нарушение природной структуры белка под действием нагревания и химических реагентов:
а) высокая или низкая температура;
б) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов (Pb, Hg и др.);
3. Цветные качественные реакции – это реакции не собственно на белки, а на определенные аминокислоты, входящие в их состав. https://www.youtube.com/watch?v=geyz_MDx4UE
 а) Биуретовая реакция – взаимодействие слабощелочных растворов белков с раствором сульфата меди (II), в результате которой появляется фиолетово-синяя окраска.
а) Биуретовая реакция – взаимодействие слабощелочных растворов белков с раствором сульфата меди (II), в результате которой появляется фиолетово-синяя окраска.
Определяет наличие пептидной связи в растворе исследуемого соединения.
б) Ксантопротеиновая реакция – взаимодействие с концентрированной азотной кислотой, которое сопровождается появлением желтой окраски. Определяет присутствие в белке ароматических и гетероциклических a - аминокислот: триптофана, фенилаланина, тирозина, гистидина.

Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. В белках присутствуют несколько типов химических группировок, способных к ионизации в водном растворе: карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь, ε-аминогруппализина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина).
Области применения аминокислот:
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.
ЛАБОРАТОРНАЯ РАБОТА № 15
«Растворение белков в воде. Обнаружение белков в молоке и мясном бульоне. Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании»
Цель: овладение навыками проведения химических опытов, подтверждающих свойства белков и их нахождение в продуктах питания.
Оборудование: штатив с пробирками, держатель, горелка, спички. Растворы: нитрата свинца, щелочи NaOH. сульфата меди (II); этиловый спирт, молоко, мясной бульон.
 2020-06-29
2020-06-29 143
143







