I. Mедь.
Медь – химически малоактивный металл, в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II).
2Cu + H2O + CO2 = (CuOH)2CO3
При нагревании медь реагирует с достаточно сильными окислителями,
с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 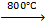 2Cu2О 2Cu + О2
2Cu2О 2Cu + О2  2CuО
2CuО
С галогенами, серой:
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Cu + S 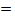 CuS
CuS
Медь растворяется в кислотах-окислителях:
при нагревании в концентрированной серной кислоте:
Cu + 2H2SO4(конц.) 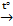 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
без нагревания в азотной кислоте:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб..) = 3Cu(NO3)2 + 2NO2 + 4H2O
3Cu + 2HNO3 + 6HCl = 3CuCl2 + 2NO + 4H2O
Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
II. Соединения меди.
1) Оксиды.
Оксид меди (II)
В лаборатории оксид меди (II) получают окислением меди при нагревании, или прокаливанием (CuOH)2CO3, Cu(NO3)2:
2Cu + O2  2CuO
2CuO
(CuOH)2CO3 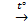 2CuO + CO2 + H2O
2CuO + CO2 + H2O
2Cu(NO3)2  2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
Оксид меди проявляет слабо выраженные амфотерные свойства (с преобладаниемосновных). СuO взаимодействует с кислотами:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
CuO + 2H+ = Cu2+ + H2O
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
3CuO + 2NH3  3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
СuO + C = Cu + CO
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
В лаборатории его получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2  CH3COOH + Cu2O↓ + 2H2O
CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2  CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Оксид меди (I) обладает основными свойствами. При действии на оксид меди (I) галогеноводородной кислотой получают галогениды меди (I) и воду:
Cu2O + 2HCl = 2CuCl↓ + H2O
При растворении Cu2O в кислородсодержащих кислотах, например, в растворе серной, образуются соли меди (II) и медь:
Cu2O + H2SO4(разб.) = CuSO4 + Cu + H2O
В концентрированной серной, азотной кислотах образуются только соли (II).
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → Сu–C ≡ C–Cu + 2NH4Cl
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
2Cu2O + O2 = 4CuO
2) Гидроксиды.
Гидроксид меди (II).
Гидроксид меди (II) проявляет слабо выраженные амфотерные свойства (с преобладанием основных). Сu(OН)2 взаимодействует с кислотами:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
Cu(OН)2 + 2H+ = Cu2+ + 2H2O
Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH )2 + 2NaOH(конц.) = Na2[Cu(OH)4]
При нагревании гидроксид меди (II) разлагается:
Сu(OH)2  CuO + H2O
CuO + H2O
3) Соли.
Соли меди (I).
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
2CuCl + Cl2 = 2CuCl2
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
4CuI + 5H2SO4(конц.гор.) = 4CuSO4 + I2 + H2S + 4H2O
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.хол.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
CuSO4 + Fe = FeSO4 + Cu
CuS + 8HNO3(конц.гор..) = CuSO4 + 8NO2 + 4H2O
CuS + 2FeCl3 = CuCl2 + 2FeCl2 + S
2CuS + 3O2  2CuO + 2SO2↑
2CuO + 2SO2↑
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
2CuCl2 + 4KI = 2CuI + I2↓ + 4KCl
CuBr2 + Na2S = CuS↓ + 2NaBr
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
2Cu(NO3)2 + 2Н2О 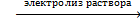 2Cu + O2 + 4HNO3
2Cu + O2 + 4HNO3
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
2Cu(NO3)2  2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
(CuOH)2CO3 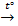 2CuO + CO2 + H2O
2CuO + CO2 + H2O
Na2[Cu(OH)4] + 4HCl = 2NaCl + CuCl2 + 4H2O
2[Cu(NH3)2]Cl + К2S = Cu2S + 2KCl + 4NH3
При смешивании растворов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
 2020-06-29
2020-06-29 115
115








