Группа Химия
Мая
1. Тема: Практическая работа №12-13 Решение задач на тему: идентификация органических соединений.
Задание: В тетради ответить на вопросы в практической работе.
Практическая работа № 12-13
Тема: Решение задач на тему: идентификация органических соединений.
Качественный анализ веществ - важная тема при изучении органической химии. Знание её помогает в работе не только химикам, но и медикам, экологам, биологам, эпидемиологам, фармацевтам, работникам пищевой промышленности. Надеюсь, что эти знания помогут вам и в повседневной жизни. Качественные реакции в химии связаны с выделением газа, образованием осадка и изменением окраски раствора.
Задания для решения
№ 1. Найдите соответствия:
| 1. Наличие альдегидной группы в молекуле H-COH можно доказать с помощью реактивов: | А) Гидроксид меди (II) |
| 2. Наличие карбоксильной группы в молекуле CH3-COOH можно доказать реакцией с: | Б) Аммиачный раствор оксида серебра (I) |
| 3. Двойственные функции муравьиной кислоты проявляются при взаимодействии с: | В) Бромная вода |
| 4. Для качественного определения уксусной кислоты применяют: | Г) Раствор перманганата калия |
| 5. Для определения непредельных углеводородов используют: | Д) Раствор хлорида железа (III) |
| 6. Для качественного определения непредельной олеиновой кислоты применяют: | Е) Раствор йода |
| 7. Для определения фенола используют: | Ж) Индикаторы |
| 8. Для определения крахмала применяют: | З) Концентрированная азотная кислота |
| 9. Для качественного определения многоатомных спиртов применяют: | И) Горение (запах жженых перьев) |
| 10 Для качественного определения глюкозы применяют: | К) Специфический запах |
| 11. Двойственные функции аминокислот проявляются при реакциях с: | Л) Раствор щелочи |
| 12. Для определения белка применяют: | М) Растворы неорганических кислот |
№ 2. Как распознать муравьиную и уксусную кислоты с помощью специфических реакций?
№ 3. Как распознать вещества: этанол, глицерин, уксусный альдегид, уксусную кислоту и глюкозу? Написать соответствующие уравнения реакций.
№ 4. Назовите несколько органических веществ, которые можно определить с помощью свежеприготовленного гидроксида меди (II).
№ 5. Назовите несколько органических веществ, для определения которых можно воспользоваться аммиачным раствором нитрата серебра.
№ 6. Как распознать следующее пары веществ:
А) олеиновая и стеариновая кислота
Б) формалин и глицерин
В) формалин и глюкоза
Г) глюкоза и белок
Д) глюкоза и глицерин
Е) метан и этилен
Тест
1. Соединения, в состав которых входит функциональная группа NН2, относятся к классу:
1) аминов; 2) нитросоединений; 3) карбоновых кислот; 4) альдегидов.
2. Гомологом этана является:
1) С2Н4; 2) С2Н6; 3) С6Н6; 4) С3Н8.
3. Пропан взаимодействует с:
1) бромом; 2) хлороводородом; 3) водородом; 4) гидроксидом натрия (р-р).
4. Этанол не взаимодействует с:
1) Сu; 2) Nа; 3) НСl; 4) О2.
5. Этилацетат образуется при взаимодействии уксусной кислоты с:
1) ацетальдегидом; 2) этиленом; 3) этиловым спиртом; 4) ацетиленом.
6. Ацетальдегид взаимодействует с:
1) этаном; 2) водородом; 3) оксидом углерода(IV); 4) толуолом.
7. Вещество Х в схеме реакции СН3СООН + СН3ОН 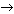 Х + Н2О:
Х + Н2О:
1) этилацетат; 2) этанол; 3) метилацетат; 4) диэтиловый эфир.
8. Метиламин взаимодействует с:
1) метаном; 2) кислородом; 3) гидроксидом кальция; 4) бензолом.
9. Непредельные углеводороды отличают от предельных с помощью:
1) H2SO4 (конц.); 2) NaOH (р-р);
3) Ag2O; 4) KMnO4 (р-р).
10. Количество вещества брома Вr2, которое может присоединить ацетилен объемом 11,2 л (н.у.) по уравнению реакции С2Н2 + 2Вr2 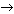 С2Н2Вr4, равно:
С2Н2Вr4, равно:
1) 1 моль; 2) 2 моль; 3) 0,5 моль; 4) 0,25 моль.
2. Тема: Итоговая контрольная работа по органической химии
Контрольная будет выложена в группу ровно в 14-00. Всем быть в дистанте.
Мая
1. Тема: Развитие представлений о строении атома. Атом сложная частица.
Задание: Просмотреть видеоурок на инфоуроке. Ответить тест.
Мая
1. Тема: Практическая работа №14-15
Задание: Письменно в тетради записать термины. Ответить тест
Практическая работа № 14-15
Тема: Электронная конфигурация атомов химических элементов и графическое изображение электронной конфигурации атомов.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
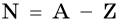
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:

Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон (е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:

В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.

Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.


Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тест
1. Общее число s-электронов в атоме кальция равно
1)20
2)40
3)8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1)7
2)14
3)3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1)7
2)14
3)3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1)18
2)6
3)4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1)9,4,5
2)4,5,4
3)4,4,5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1)3-м периоде, IА группе
2)2-м периоде, IVА группе
3)3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1)2, 8, 6
2)2, 6, 4
3)2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1)ЭН
2)ЭН2
3)ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1)его порядковому номеру
2)номеру группы
3)числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1)порядковому номеру элемента
2)номеру группы
3)числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1)He, Be, Ba
2)Mg, Si, O
3)C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1)Li2O
2)MgO
3)K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1)2,6
2)3,4
3)3,16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1)хлора
2)серы
3)магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1)2s
2)2p
3)3s
4) 3p
16. Атомы азота и фосфора имеют
1)одинаковое число нейтронов
2)одинаковое число протонов
3)одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1)калия
2)алюминия
3)бериллия
4) бора
18. Атомы углерода и фтора имеют
1)одинаковое число нейтронов
2)одинаковое число протонов
3)одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1)1
3)3
2)2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1)2
3)4
2)8
4) 6
 2020-06-29
2020-06-29 480
480






