Дифференциально сканирующая калориметрия
Калориметрия – группа методов физико-химического анализа, в которых измеряется теплота различных процессов:
1. химических реакций;
2. фазовых переходов;
3. теплоемкость (теплота, необходимая для изменения температуры тела).
Теплота – функция, характеризующая процесс перераспределения внутренней энергии в пространстве; ее невозможно измерить при отсутствии процесса теплопереноса. Поэтому в конструкции любого калориметра предусмотрена возможность теплообмена между различными частями измерительной системы, и понимание явлений, связанных с теплопереносом, имеет принципиальное значение в калориметрии.
В методе ДСК теплоту определяют через тепловой поток – производную теплоты по времени (отсюда в названии термин «дифференциальный»). Тепловые потоки измеряются по разнице температур в двух точках измерительной системы в один момент времени. Измерения можно проводить как в изотермических условиях, так и в динамическом режиме при программируемом изменении температуры оболочки (нагревателя) (калориметры такого типа называют «сканирующими»). В современных приборах предусмотрена возможность задавать различные температурные программы:
1 Линейное нагревание/охлаждение с заданной скоростью.
2. Термомодулированный режим (TM-DSC). На линейное изменение температуры накладываются периодические колебания.
3. Комбинация различных температурных сегментов (изотермических, динамических, модулированных).
Все ДСК имеют две измерительные ячейки: одна предназначена для исследуемого образца (sample, S), в другую – ячейку сравнения (reference, R), помещают либо пустой тигель, либо тигель с образцом сравнения – эталоном (инертным в заданном диапазоне условий веществом, по теплофизическим свойствам близким к образцу). Ячейки конструируют максимально симметрично (одинаковые тигли, одинаковые сенсоры, одинаковое расстояние от нагревателя (furnace, F) до сенсора и т.д.). Экспериментально измеряется временная зависимость разницы температур между ячейкой с образцом и ячейкой сравнения.
Эксикаторный метод (метод навесок)
Методика измерений. Для получения сопоставимых результатов первоначально образцы высушивают до постоянного веса (вакуумный пост, сухой эксикатор). Далее сухие образцы помещают в эксикатор. Техника измерений мало отличается от стандартной: образцы через определенные промежутки времени извлекают из эксикаторf, помещают в чашки Петри и взвешивают на аналитических весах с точностью 0,1 мг.
В качестве результатов исследования была сделана таблица сравнения водопоглощения и гептанопоглощения исходного и катиономодифицированных цеолитов: калия, кальция, натрия.
Обсуждение результатов
Методика модифицирования цеолита.
В качестве образца служил клиноптилолит из Хонгуринского месторождения. Его измельчили в планетарной мельнице c агатовыми шарами для получения измельченного цеолита. Затем проводилось их истирание в порошок и сортировка по размеру с помощью вибросит. Необходимый размер частиц 0,007 – 0,009 мм. Образцы тщательно промывались дистиллированной водой и сушились при 150 ºC в течение 3 часов. Затем проводилась модификация в водных растворах калия, кальция и натрия. В чашку Петри заливали раствор необходимой концентрации и навеску образца цеолита, в течение 4 суток. После образцы тщательно промывались несколько раз дистиллированной водой и сушились.
Ионный обмен – одна из характерных особенностей цеолитов замещать собственные катионы Na+, K +, Ca2+, Mg2+, Sr2+, Ba2+ и др., находящиеся во внутренних каналах и полостях кристаллической решетки, на другие ионы из контактируемого раствора или расплава. Это происходит благодаря наличию сильной ковалентной связи кислорода с кремнием и алюминием и слабой, преимущественно ионной, связи обменных катионов с алюмокремнекислородным каркасом. Кроме этого, наличие в их структуре открытых полостей и широких каналов, в которых располагаются обменные катионы, способствует легкости протекания ионообменных реакций даже при низких температурах. Ионообменные свойства цеолитов характеризуются обменной емкостью, которая определяется способностью цеолита обменивать внекаркасные ионы на ионы из раствора солей [2]. Различают максимальную (предельную) обменную емкость и обменную емкость, реализующуюся при определенных физико-химических условиях. Ионообменная емкость, степень обмена, преобладающий тип обменных катионов – важные технологические параметры цеолита, которые могут являться диагностическими при разведке, а также при детальных минералогических исследованиях
Гетерогенный ионообменный процесс, имеющий место как в природных, так и в синтетических цеолитах, и вне зависимости от того, происходит он на поверхности частиц или во всем их объеме, протекает по схеме [19]:
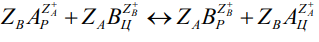
где ZA и ZB – заряды обменивающихся ионов А и В; индексы Р и Ц относятся к раствору и цеолиту соответственно.
Кинетическая кривая гетерогенного ионообменного процесса представлена на рисунке 1 [8, 11, 26].
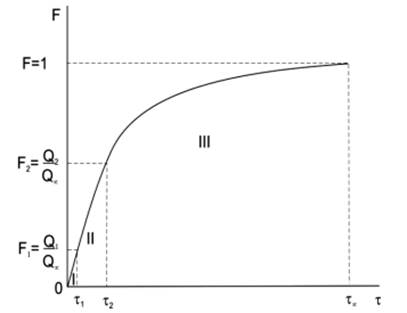
Рис. 1. Кинетическая кривая гетерогенного ионообменного процесса: (I – внешнедиффузионная область, II – переходная область, III – внутридиффузионная область, величина F – степень поглощения входящего катиона представляет собой отношение удельных обменных емкостей цеолита(способностью цеолита обменивать внекаркасные ионы на ионы из раствора солей) в данный момент времени Qτ и при бесконечно большом времени Q∞ соответственно, τ – время контакта цеолита с раствором)
Как видно из рисунка, в ходе ионного обмена в интервале времени от 0 до τ∞, где τ∞ – время установления равновесия обмена между раствором и цеолитом, действуют два механизма: внешне- и внутридиффузионный [8,11,13, 26]. Благодаря наличию достаточно большого числа обменных центров на поверхностях кристаллов, очевидно, что в интервале от 0 до τ1, при τ1→ 0 количество поглощенного катиона 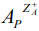 будет определяться только обменом, протекающим на поверхности частиц цеолита, т. е. внешнедиффузионным механизмом [26].
будет определяться только обменом, протекающим на поверхности частиц цеолита, т. е. внешнедиффузионным механизмом [26].
В силу того, что время τ1 очень мало, концентрация исходного раствора в этом интервале времени остается практически постоянной. В интервале от τ1 до τ2, где τ2 – время установления равновесия между ионами 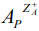 и
и 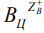 на поверхности гранулы цеолита, количество поглощенного катиона
на поверхности гранулы цеолита, количество поглощенного катиона 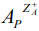 будет определяться отношением скоростей обмена на поверхности и внутри объема гранулы цеолита [26]. В интервале между τ2 и τ∞ количество поглощенного катиона
будет определяться отношением скоростей обмена на поверхности и внутри объема гранулы цеолита [26]. В интервале между τ2 и τ∞ количество поглощенного катиона 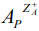 определяется только обменом во внутрикристаллическом пространстве цеолита, т. е. внутридиффузионным механизмом
определяется только обменом во внутрикристаллическом пространстве цеолита, т. е. внутридиффузионным механизмом
ДСК. Объект термических измерений – цеолит - клиноптилолит, образцы Спиридонова А.(ИПНГ). Измерения выполнены на приборе синхронного термического анализа фирмы NETZSCH – STA 449C Jupiter (Германия). Образцы в виде порошка, серовато - зеленоватого оттенка, с разными навесками (3,3977 - 6,3256) в мг нагревались в интервале температур от комнатной до 1200оС, в PtRh тиглях с подложкой из порошка Al2O3, со скоростью нагрева 10оС/мин, в инертной аргоновой среде. Исходный образец нагревался до 1300оС.
На ДСК кривых нагревания в основном фиксируются эндотермические пики примерно при температурах 45оС, 92,4 – 95оС, 156-200оС - удаление воды (дегидратация), 565,8-571оС – присутствие кварца в образце и более широкий эндотермический эффект при 1010оС – разрушение структуры и аморфизация образца. Общий волнообразный характер кривых ДСК в низкотемпературной области свидетельствует о существовании нескольких форм связанной воды в образцах. Полные потери массы образцов при нагревании до 1200оС составили примерно 5 -10%. Максимальная потеря влаги происходит с глубоким эндотермическим эффектом в интервале 40-400оС. При 1200оС в некоторых образцах произошло кристаллизация продуктов распада (превращение в стекловидное вещество).
(Эндотермические эффекты – поглощение тепла, экзотермические эффекты – выделение тепла. Низкотемпературный эндотермический эффект отражает потерю воды, в то время как высокотемпературный экзотермический эффект - превращение цеолита в другую аморфную или кристаллическую фазу).
Результаты дифференциальной сканирующей калориметрии синтезированных образцов представлены на рис. 1, 2, 3, 4. Обнаружены эндотермические и экзотермические эффекты на кривых ДСК при нагревании. Эндотермические пики отмечены при температурах ниже 100°С и характеризуют процесс десорбции воды из цеолита.
Вода в цеолитах может находиться в нескольких формах: как адсорбированная влага на поверхности межкристаллитных пор (её удаление происходит в диапазоне 50 – 200°С); в форме координированных обменными катионами аквакомплексов (удаление до 350°С); как координированная водородными связями в каналах и полостях кристалла (до 450°С); в виде гидроксильных групп каркаса (до 600°С). Следовательно, описанный тепловой эффект указывает на удаление поверхностной воды без структурных изменений каркаса. Дальнейшее нагревание характеризуется слабовыраженными изгибами на кривых ДСК, свидетельствующими о нескольких одновременно протекающих эндотермических процессах, связанных с удалением воды разных форм. Массопотеря для всех образцов примерно одинаковая от 3-4,5 % при 100°С, кроме Са где она составляет 1,93%. Это говорит о том что водопоглотительная способность у образца с Са больше остальных.
 2020-06-29
2020-06-29 145
145






