Карбоновые кислоты
Цель: изучить строение, способы получения, свойства карбоновых кислот План лекции
1. Строение карбоновых кислот
2. Способы получения
3. Химические свойства карбоновых кислот
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН(малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH бутановая);
непредельные (CH2=CH-COOH пропеновая);
ароматические (C6H5COOH бензольная).
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса - овая и слова кислота:
HCOOH - метановая (муравьиная) кислота,
CH3COOH – этановая (уксусная) кислота.
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Электронная плотность p-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создаётся недостаток электронной плотности, и он притягивает к себе неподелённые пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.

В водном растворе карбоновые кислоты диссоциируют на ионы:

Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.

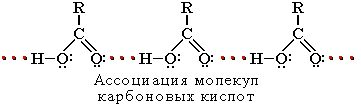
Способы получения
1. CH3-CCl3 + 3NaOH ® СH3-COOH + 3NaCl + H2O (гидролиз тригалогенопроизводных)
2. R-CHO +[O] ® R-COOH (окисление альдегидов и кетонов)
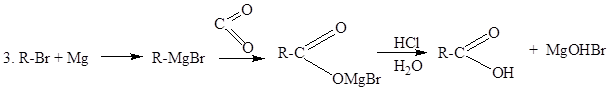
4. СH3-CH=CH2 + CO + H2O/ H+ ® CH3-CH2-CH2-COOH (Ni, p, t) (оксосинтез)
5. CH3CºN + 2H2O/ H+ ® CH3COOH + NH4+ (гидролиз нитрилов)
6. СO + NaOH ® HCOONa; 2HCOONa + H2SO4 ® 2HCOOH + Na2SO4 (получение НСООН)
7. 2CH3CH2CH2CH3 + 5O2 ® 4CH3COOH + 2H2O (получение уксусной кислоты)
Химические свойства
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на величину рКа карбоновых кислот
1. Донорные группы увеличивают прочность связи кислород-водород или дестабилизируют карбоксилат- анион, это приводит к увеличению силы кислот (значение рКа увеличивается).


рКа 3,75 4,76 4,86
2. Акцепторные группы уменьшают электронную плотность связи кислород-водород или стабилизируют карбоксилат- анион, это приводит к уменьшению силы кислот (значение рКа уменьшается).

рКа 0,66 1,25 2,87 4,76
I. С металлами, оксидами металлов, солями образуют соли
а) 2СH3COOH + Fe ® (СH3COO)2Fe + H2 ( образование солей, соли уксусной кислоты - ацетаты)
б) 2CH3COOН + MgO ® (CH3COO)2Mg + H2O;
в) CH3COOH + KOH ® CH3COOK + H2O;
г) CH3COOH + NaHCO3 ® CH3COONa + CO2 + H2O





VI. CH3-COOH + Cl2  Cl-CH2-COOH + HCl ( галогенирование в a-положение)
Cl-CH2-COOH + HCl ( галогенирование в a-положение)
VII. НO-CH=O + Ag2O  2Ag + H2CO3 (H2O + CO2) (особенностиНСООН)
2Ag + H2CO3 (H2O + CO2) (особенностиНСООН)
HCOOH  CO + H2O
CO + H2O
 2020-07-01
2020-07-01 498
498






