Мая 2020 г. (пятница)
Дисциплина: Химия
Группа: № 74
Урок № 38
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Видеоурок https://www.youtube.com/watch?v=05vTyjaed9w
Тема: Водородный показатель – рН.
Цель: сформировать понятие о pH, ионном произведении воды, константе её диссоциации.
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
В очень разбавленных растворах водородный показатель эквивалентен концентрации ионов водорода. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
pH = -lg[H+]
При стандартних условиях значение pH лежит в приделах от 0 до 14. В чистой воде, при нейтральном pH, концентрация H+ равна концентрации OH- и составляет 1·10-7 моль на литр. Максимально возможное значение pH определяется как сумма pH и pOH и равна 14.
Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль/л, pH = 15, при концентрации ионов гидроксида [OH-] 10 моль/л pOH = −1.
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Вода – слабый электролит, диссоциирующий на ионы H+ и OH- - анионы.
Этому процессу соответствует константа диссоциации воды:
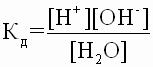 ,
,
так как диссоциирует ничтожная часть молекул воды, то [H2O] – постоянная величина,
Кд* [H2O] = К H2O = [H+] [OH-] – ионное произведение воды,
К H2O = 1*10-14 (при 25° С)
К H2O – величина постоянная. Зная [H+], можно вычислить [OH-] и наоборот.
При [H+] = [OH-] = 10 -7 моль/л – среда нейтральная
При [H+] > [OH-], [H+ ] > 10-7 моль/л – среда кислая
При [H+] < [OH-], [H+ ] < 10-7 моль/л – среда щелочная
Для характеристики среды растворов используют водородный показатель pH, который определяется как отрицательный десятичный логарифм концентрации ионов водорода [H+]
pH = - lg [H+]
если pH = 7 – среда нейтральная
pH > 7 - среда щелочная
pH < 7 - среда кислотная
Пример. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3).
Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, а масса воды – 99,7 г. По уравнению (4.4) вычислим моляльную концентрацию:
2. Согласно уравнению диссоциации H2SO4 ® 2H+ + SO42-, из 1 моль серной кислоты образуется 2 моль H+, следовательно,
3. По уравнению (4.13) вычислим рН = –lg[H+] = –lg0,062 = = 1,21.
Пример. Определить рН, если раствор одноосновной кислоты с рН = 5,5 разбавлен в 100 раз.
Решение. По уравнению (4.14) найдем концентрацию ионов водорода в конечном растворе
и вычислим
рН2 = –lg[H+]2 = –lg1,15×10-7 = 6,9.
Домашнее задание (решите задачу):
Определить значение рН при смешении 10 л раствора с рН1 = 2 и 17 л раствора с рН2 = 4.
Ответьте на вопросы:
1.Как определяют водородный показатель?
2.Как выражают водородный показатель в формулах?
3.Каковы методы определения pH?
Внеаудиторная (самостоятельная) работа студентов:
Подготовить сообщение по теме «Электролитическая диссоциация».
мая 2020 г. (пятница)
Дисциплина: Химия
Группа: № 74
Урок № 39
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Видеоурок https://www.youtube.com/watch?v=0RCFox-oR_o
Тема: Реакции ионного обмена.
Цель урока: Сформировать у обучающихся умение составлять ионные уравнения химических реакций.
Задачи:
Образовательные:
- формировать представление о реакцияхобмена с точки зрения электролитической диссоциации;
Воспитательные:
-научить обучающихся составлять полные и сокращённые ионные уравнения.
Развивающие:
- продолжить развивать умение логически правильно высказывать мысли, исследовательские навыки; развивать мышление через анализ, синтез и сравнение.
Реакции обмена протекают между ионами, поэтому называются реакции ионного обмена Выводится определение (слайд 2):
Реакции ионного обмена идут до конца в трех случаях:
· если образуется осадок – нерастворимое вещество после реакции)
· если выделяется газ
· если образуется вода
В остальных случаях реакции обмена являются обратимыми.
 2020-07-12
2020-07-12 101
101







