Цель: рассмотреть условия протекания обратимых и необратимых реакций
В предыдущей лекции мы с вами рассматривали классификацию химических реакций и одним из пунктов была классификация по признаку обратимости.
По признаку обратимости реакции делятся на обратимые и необратимые.
Схема «Классификация химических реакций по признаку направления протекания»
| Реакции
| |
| обратимые | необратимые |
Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
Обратимые химические реакции – это реакции, которые одновременно протекают в двух противоположных направлениях (прямая «слева направо» и обратная «справа налево»).
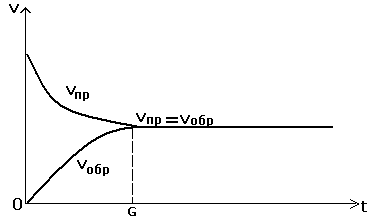
Рассмотрим реакцию типа А+ В ↔ С. В самом начале реакции в сосуде находятся только вещества А и В, потому что продукт реакции С еще не успел образоваться. В ходе реакции химические количества и концентрации исходных веществ А и В постепенно уменьшаются, а значит и скорость прямой реакции тоже уменьшается. В то же время химическое количество и концентрация продукта прямой реакции С увеличиваются, что означает, что скорость обратной реакции тоже увеличивается. Через некоторый отрезок времени наступает такое состояние, при котором скорости прямой и обратной реакции становятся одинаковыми.
График «Изменение во времени скорости прямой и обратной реакций.
Например:
3H2 + N2 ⇆ 2NH3
Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇆ 2NO2
складывается из элементарных двух реакций
N2O4 ⇆ 2NO2
2NO2 ⇆ N2O4
Необратимой называется реакция, которая идет практически до конца в одном направлении. Условия необратимости реакции – образование осадка, газа или малодиссоциированное соединение, например, вода.
Необратимые химические реакции – это реакции, которые протекают только в одном направлении («слева направо»), в результате чего исходные вещества почти полностью превращаются в продукты реакции. К такому типу реакций относятся реакции горения, реакции в которых образуются газ, малорастворимое или малодиссоциирующее вещество.


Рассмотрим примеры протекания необратимых реакций.
Реакции, протекающие с образованием осадка:
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
Запишем полное и краткое ионные уравнения:
2Na+ + OH− + Cu2+ +SO42− = 2Na+ + SO42− + Cu(OH)2↓
Cu2+ + OH− = Cu(OH)2↓
Реакции, протекающие с образованием газа:
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2↑
Запишем полное и краткое ионные уравнения:
2H+ + NO3− + 2Na+ + CO32− = 2Na+ + 2NO3− + H2O + CO2↑
2H+ + CO32− = H2O + CO2↑
Реакции, протекающие с образованием малодиссоциированного соединения, например, воды:
Ва(OH)2 + 2HCl = ВаCl2 + 2H2O
Ва2+ + 2OH− + 2H+ + Cl− = Ва2+ + 2Cl− + 2H2O
2H+ + 2OH− = 2H2O
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Домашнее задание: изучитьматериал лекции,законспектировать 0.2§ 12 стр.57 прочесть (Химия 11 кл. Г.Е.Рудзитис)
Ответьте на вопросы :
1. Какие реакции называются обратимыми?
2. Какие реакции называются необратимыми?
3. При каких условиях протекают необратимые реакции?
4. Напишите уравнение реакции взаимодействия хлорида калия с нитратом серебра в молекулярном виде, а также полное и краткое ионные уравнения.
 2020-07-12
2020-07-12 191
191






