Растворы ВМС представляют собой молекулярно-дисперсные системы. Растворенное вещество в них содержится в виде отдельных длинных гибких макромолекул цепочечного строения.
Растворы ВМС — это гомогенные, однофазные системы.
Высокомолекулярные соединения могут давать не только истинные растворы, но и типичные золи, если дисперсная фаза лиофобна по отношению к дисперсионной среде.
Так, можно получить типичные золи желатин—спирт, нитроцеллюлоза—вода. Вообще растворы ВМС совмещают в себе свойства как истинных растворов НМС, так и коллоидных растворов, поэтому их выделяют в особый класс и называют квазиколлоидными системами.
Способность полимеров растворяться или набухать обусловлена многими факторами:
· химической природой полимера и растворителя;
· молекулярной массой полимера;
· гибкостью цепи полимера;
· плотностью упаковки макромолекул;
· фазовым состоянием полимера;
· неоднородностью химического состава цепи; наличием и частотой пространственной сетки;
· температурой.
Набухание и растворение ВМС
Процесс поглощения ВМС больших объемов низкомолекулярной жидкости, сопровождающейся значительным увеличением объема ВМС, называется набуханием.
На первой стадии взаимодействия ВМС и низкомолекулярной жидкости, образуется гетерогенная система, состоящая из ВМС и свободной низкомолекулярной жидкости.
Процесс проникновения молекул растворителя в макромолекулы ВМС приводит к тому, что при набухании объем полимера всегда увеличивается, а объем всей системы уменьшается. Уменьшение объема системы при набухании, называемая контракцией.
При набухании происходит диффузия молекул растворителя в высокомолекулярное вещество.
Процесс растворения ВМС можно разделить на четыре стадии:
1. Начальная стадия.
Система гетерогенна и двухфазна. Представляет собой чистую низкомолекулярную жидкость и чистый полимер.
2. Стадия набухания.
На этой стадии система расслаивается на две жидкие фазы. Одна фаза – раствор низкомолекулярного компонента в компоненте ВМС. Вторая фаза - чистая низкомолекулярная жидкость.
3. Стадия образования второго раствора. Жидкий растворитель дифуззирует в полимер.
4. Стадия полного растворения – превращение гетерогенной (двухфазной) системы в гомогенную.
Существуют ограниченное и неограниченное виды набухания.
Ограниченное – набухание не переходит со временем в полное растворение, а останавливается на второй или третьей стадии. Примером может служить набухание при комнатной температуре желатина.
Неограниченное набухание представляет непрерывный процесс, переходящий через все четыре стадии и заканчивающийся полным растворением. Образуется однофазная система. Например, так набухают каучуки в бензоле, нитроцеллюлоза в ацетоне, белок в воде, целлюлоза в ацетоне.
Теплота и давление набухания. Тепловой эффект процесса набухания полимера называют теплотой набухания. Различают два вида теплоты набухания:
интегральная — количество теплоты, которое выделяется при набухании 1 г сухого вещества до заданной концентрации студня или до полного насыщения;
дифференциальная — количество теплоты, которое выделяется при поглощении сухим полимером 1 г жидкости. По выделяющейся теплоте набухания судят о лиофильности полимера.
Изменение объема набухшего полимера может характеризовать массу поглощенной жидкости. Если набухание вести в сосуде, т.е. в условиях, ограничивающих увеличение объема, то возникает значительное давление на стенки сосуда — давление набухания
Механизм растворения высокомолекулярных соединений. Диффузия огромных макромолекул исключительно мала. Поэтому состояние равновесия при смешении полимера с низкомолекулярным растворителем достигается не скоро, т.е. образование раствора полимера является длительным процессом.
Подвижные молекулы низкомолекулярного растворителя быстро заполняют пространства между звеньями цепи полимера. Происходит процесс набухания. Набухание полимера — изменение массы и объема полимера при его контакте с низкомолекулярными жидкими или газообразными соединениями — обусловлено поглощением их полимером.
Набухание и последующее растворение как две стадии смешения ВМС с растворителем резко отличаются одна от другой. Набухание возникает вследствие резкого различия скоростей диффузии малых молекул низкомолекулярного растворителя и огромных макромолекул ВМС. И лишь через продолжительное время, когда пространственное разделение цепных молекул становится значительным, теряется их прочность, они отрываются друг от друга и очень медленно проникают в объем растворителя.
Роль воды при набухании. В набухшем полимере различают два вида воды: связанную, или гидратационную, и свободную, или капиллярную. Особый теоретический и практический интерес представляет связанная вода, количество которой в полимере зависит от его гидрофильности. Чем выше гидрофильные свойства полимера, тем больше связанной воды он содержит. Например, содержание связанной воды в желатине в 2 раза превышает массу сухого вещества.
Экспериментально установлено, что связанная вода значительно отличается от свободной, которая в набухшем полимере играет роль среды. Если молекулы свободной воды движутся хаотически, то молекулы связанной воды обладают определенной упорядоченностью.
Степень набухания
В результате диффузии молекул жидкости в среду полимерного образца объем последнего резко увеличивается.
Процесс набухания характеризуется степенью набухания α:
 | 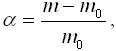 |
где m - масса полимера после набухания, m 0 - масса сухого полимера.
Степень набухания может достигать большой величины. Например, для каучука в бензоле степень набухания может достигать 1000 ÷ 1500 %.
Чем гибче цепи макромолекул, тем интенсивнее процесс набухания. Процесс сильно зависит от величины межмолекулярного взаимодействия полимера и жидкости и сопровождается тепловым эффектом.
Теплота и давление набухания. Тепловой эффект процесса набухания полимера называют теплотой набухания. Различают два вида теплоты набухания:
интегральная — количество теплоты, которое выделяется при набухании 1 г сухого вещества до заданной концентрации студня или до полного насыщения;
дифференциальная — количество теплоты, которое выделяется при поглощении сухим полимером 1 г жидкости. По выделяющейся теплоте набухания судят о лиофильности полимера.
Изменение объема набухшего полимера может характеризовать массу поглощенной жидкости. Если набухание вести в сосуде, т.е. в условиях, ограничивающих увеличение объема, то возникает значительное давление на стенки сосуда — давление набухания
Явление вязкости в растворах ВМС
Повышенная вязкость растворов ВМС связана с формой макромолекул и характером межмолекулярных взаимодействий и объясняется большой сольватацией макромолекул.
Вязкость растворов высокомолекулярных соединений, обычно выше вязкости растворов низкомолекулярных соединений и коллойдных растворов, взятых с одинаковой концентрацией.
При исследовании растворов ВМС характеристическую вязкость обозначают через.
Причиной отклонения вязкости растворов ВМС является взаимодействие вытянутых и гибких макромолекул, часто образующих структуированные системы. Такие системы получили название ассоциаты.
Ассоциаты обладают свойством сильно увеличивать вязкость растворов.
Устойчивость растворов ВМС
Изменение растворимости ВМС может быть вызвана либо понижением температуры, либо изменением состава раствора путем добавления жидкости, в которой ВМС не растворяется.
Все процессы нарушения устойчивости растворов ВМС связаны с переходом от полного растворения ВМС к ограниченному растворению или к нерастворимости.
Введением в раствор электролитов, напрямую связано с нарушение устойчивости растворов ВМС.
Механизм коагуляции лиофобных коллоидов и нарушение устойчивости ВМС различны по своему действию, т.к. коагуляция золей происходит при введении малых концентраций электролита и представляет собой обычное необратимое явление.
При добавлении в раствор ВМС электролита наблюдается эффект высаливания, что объясняется уменьшением растворимости ВМС в концентрированном растворе электролита.
Высаливание полимеров
Агрегативная устойчивость термодинамически равновесных растворов ВМС может быть нарушена при введении в них больших количеств электролитов. Выделение ВМС из растворов по своему характеру отличается от коагуляции типичных коллоидных систем.
Механизм выделения ВМС из раствора состоит в уменьшении их растворимости в концентрированном растворе прибавленного электролита. Выделенное ВМС после удаления из него путем диализа электролита можно снова растворить. Коагуляция растворов ВМС называется высаливанием, или выделением растворенного полимера из раствора.
Механизм высаливания состоит в нарушении связи между полимером и растворителем.
При введении соли часть молекул растворителя, которые были связаны с полимером, соединяются с молекулами добавленной соли. Чем больше введено соли, тем больше молекул растворителя покинет макромолекулы полимера. Из-за недостатка растворителя раствор полимера станет пересыщенным, что повлечет за собой выпадение полимера в осадок.
Всякое соединение, способное соединяться с растворителем полимера и понижать его растворимость, пригодно для высаливания. Поэтому нет необходимости применять электролит в качестве высаливающего средства. Так, желатин отлично высаливается из водного раствора спиртом. Степень растворимости полимера в данном растворителе сказывается на высаливании: чем ниже растворимость, тем быстрее и полнее происходит высаливание.
Для белков высаливание зависит от рН среды. Растворы белков коагулируют лишь при повышенных температурах и при воздействии концентрированных кислот и щелочей. В результате этого белок изменяется химически, т.е. происходит необратимая коагуляция (денатурация).
По своему влиянию на высаливание ионы располагаются в последовательности, называемой лиотропным рядом.
Например, катионы по мере уменьшения их высаливающего действия расположены в ряду так: Li+ > Na+ >К+ > Rb+ > Cs+.
Анионы составляют следующий лиотропный ряд:
S042¯ > CI¯ > N03¯ > Вr¯ > I¯ > CNS¯.
 2020-07-12
2020-07-12 2783
2783






