Группа № 183, Урок № 67-72, Основы аналитической химии
Преподаватель Челтыгмашев П.И.
Укрупненная тема «Осажденное титрование»
Для выполнения задания Вам необходимо:
1. Изучить материал:
Методы осадительного титрования
Мудрость аналитика гласит, все, что не компонент раствора, – компонент осадка, отсюда осадительное титрование – титрование, основанное на реакциях осаждения.
В качестве методов осадительного титрования широко практикуется аргентометрия (титрант – раствор AgNO3), реже применяются роданидометрия (титранты – растворы KSCN или NH4SCN).
В данных методах титранты готовят по точным навескам препаратов. Хлорид натрия – первичный стандарт, его раствор готовят по точной навеске, раствор может храниться достаточно долго. Раствор нитрата серебра можно приготовить по точной навеске, однако вследствие изменения титра при хранении, его периодически проверяют по стандартному раствору хлорида натрия. Титр растворов роданидов устанавливают по стандартизованному раствору нитрата серебра.
Осадительное титрование имеет ограниченное применение, что связано с неколичественным и нестехиометрическим протеканием многих реакций.
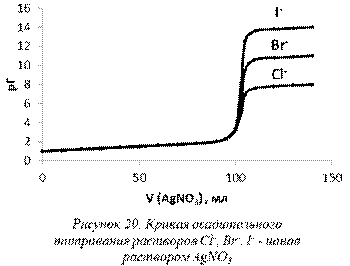
Кривые титрования (рис.20) строят в координатах pГ – Vтитранта, где Г=Cl–, Br– или I–; pГ=-lg[Г].
В методе аргентометрии используют как безиндикаторные, так и индикаторные способы фиксирования конечной точки титрования.
| Безиндикаторные способы. Хлорид-ионы определяют по способу равного помутнения (метод Гей-Люссака). При этом анализируемый раствор титруют стандартным раствором нитрата серебра, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора AgNO3, в другую – каплю стандартного раствора NaCl такой же концентрации. |
В недотитрованном растворе появляется помутнение в пробирке с нитратом серебра, в перетитрованном - в пробирке с хлоридом натрия. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
Индикаторные способы. В зависимости от применяемого индикатора в аргентометрии различают следующие методы:
ü метод Мора. Индикатором служит хромат-ион, который образует красно-кирпичный осадок Ag2CrO4, более растворимый, чем галогениды серебра.
ü метод Фольгарда (тиоцианатометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа (III) в качестве индикатора. После оттитрования ионов Ag избыток титранта дает с ионами Fe3+ красный комплекс.
ü метод Фаянса - Ходакова основан на применении адсорбционных индикаторов (ализариновый красный, бромфеноловый синий, флуоресцеин и пр.): реакции протекает на поверхности осадка AgA, где А — анион.
Задания для самостоятельного решения
1. Из водного раствора объемом 100 мл, содержащего смесь гидроксида и карбоната натрия, отобрали аликвоту 20 мл для определения щелочи и карбоната при их совместном присутствии. Титрование проводили 0,1 М раствором HCl в присутствии двух индикаторов: вначале – фенолфталеин, затем – метиловый оранжевый. Рассчитайте концентрацию и массу NaOH и Na2CO3 в исходном растворе, если на титрование аликвоты затрачено вначале 18 мл, а затем 22 мл титранта.
2. Точка перехода фенолфталеина при рН = 8,5. При рН>8,5 он малиновый, при рН<8,5 – бесцветный. Сколько грамм-эквивалентов NH4Cl надо прибавить к 50 мл 0,1 н. NH4OH
(K = 1,8·10-5), чтобы в присутствии фенолфталеина раствор был окрашен?
3. Анализируемый раствор NaOH объемом 20 мл и концентрацией 0,1 моль/л оттитровали стандартным раствором HCl с концентрацией 0,01 моль/л. Определите объем кислоты пошедшей на титрование. Какой индикатор можно использовать для данного определения NaOH?
4. Рассчитайте молярную массу эквивалента H3PO4 в реакциях с NaOH с образованием NaH2PO4, Na2HPO4, Na3PO4.
5. Раствор NaOH объемом 20 мл с концентрацией 0,1 моль/л оттитровали стандартным раствором HCl такой же концентрации. Рассчитайте рН титруемого раствора при добавлении 20 мл кислоты.
6. Рассчитайте молярную массу эквивалента бромата калия KBrO3 и мышьяка (III) в ОВР между BrO3- и AsO33- в кислой среде.
Задание присылать не позднее 12,00 следующего за публикацией дня.
Фото ответов направлять на электронную почту batzfo@yandex.ru либо личным сообщением https://vk.com/pavelchelt,
ПРЕДПОЧТИТЕЛЬНО в виде комментарий под заданием в сообществе в ВК.
 2020-08-05
2020-08-05 68
68






