Решение расчетных задач
Массовая доля растворенного вещества В
(ω в) – это отношение массы вещества В (т в) к массе раствора (m (р)):
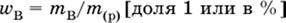 |
При решении ω в выражается всегда в долях единицы (например, ω в = 0,01), в ответе –
часто в процентах (ω в=1 %).
Величина, численно равная ω в (в %), характеризует раствор в целом, например, при ω в = 1 % раствор будет однопроцентным (1 %-ный раствор вещества В).
Соотношения для массы раствора:
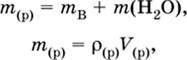 |
где ρ(р) – плотность и V(p) – объем раствора.
Для воды условно считается, что ее масса и объем численно равны, т. е. плотность принимается равной 1 г/мл или 1000 г/л.
Если для приготовления раствора берется кристаллогидрат некоторой соли (а не сама безводная соль), то используются соотношения:
а) масса кристаллогидрата В хН2O
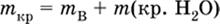 |
где m (кр. Н2O) – масса воды, которая содержится в данной массе кристаллогидрата; б) масса безводной соли В в кристаллогидрате
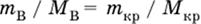 |
так как n в = n кр;
б) масса добавляемой воды
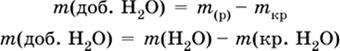 |
где т( Н2O) – суммарная масса воды в приготовленном растворе.
В лабораторной практике часто приходится готовить разбавленный раствор вещества (величины с индексом ') из концентрированного раствора того же вещества (величины с индексом ") путем разбавления водой.
Масса растворенного вещества при разбавлении не изменяется:
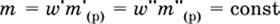 |
Масса добавляемой воды определяется соотношением:
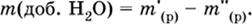 |
Для приготовления концентрированного раствора вещества В из разбавленного раствора применяют два способа.
а) Выпаривание некоторой порции воды из начального раствора. При этом масса растворенного вещества не меняется.
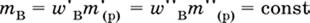 |
а масса воды, которую удаляют из раствора, определяется соотношением:
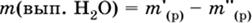 |
б) Добавление некоторой порции вещества В в начальный раствор. При этом масса воды
не изменяется:
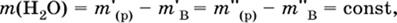 |
а масса добавленного вещества определяется соотношением
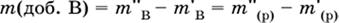 |
Для приготовления раствора с промежуточным составом (величины без индексов) проводят смешивание концентрированного и разбавленного растворов вещества В. При этом все величины связаны соотношениями:
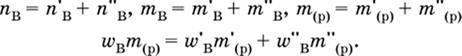 |
Примеры решения задач
1. Вычислите объем (в литрах, н.у.) аммиака, который полностью поглощается водой с образованием 500 г 20 %-ного раствора.
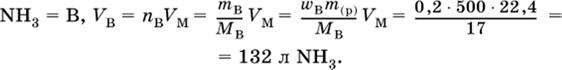 |
2. Какую массу (в граммах) кристаллогидрата Na2CO3 10Н2O следует использовать для приготовления 250 г 15 %-ного раствора безводной соли?
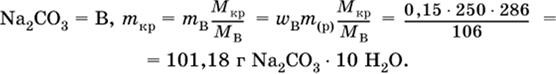 |
3. До какого объема (в литрах) надо разбавить водой 250 мл 30 %-ного раствора нитрата аммония (плотность раствора 1,13 г/мл), чтобы приготовить 10 %-ный раствор (плотность 1,04 г/мл)?
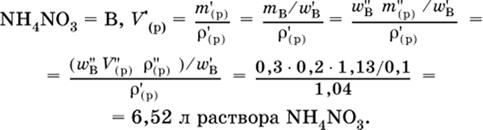
4. Установите массу (в граммах) выпаренной воды из 300 мл 4%-ного раствора хлорида бария (плотность раствора 1033 г/л), если приготовлен 10 %-ный раствор.
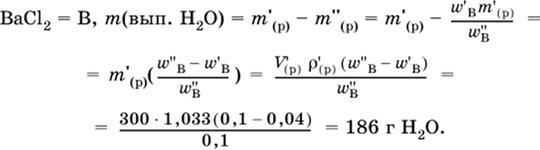 |
5. Вычислите массу (в граммах) порции гидроксида калия, которую добавили в 400 г
5%-ного раствора этого вещества и довели массовую долю до 40 %.
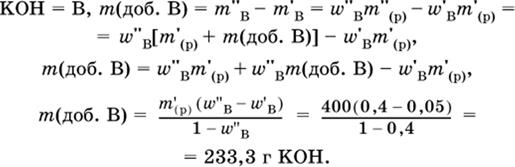 |
6. Определите массовую долю (в %) серной кислоты в конечном растворе, приготовленным смешиванием 90 г 5%-ного и 120 г 40 %-ного растворов этого вещества.
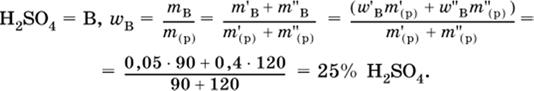 |
Задания для самостоятельного решения части В
1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65
моль соли и 300 мл воды.
2. Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта.
3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ный формалин.
4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75
моль кристаллогидрата ZnSO4 7Н2O и 600 г воды.
5. Найдите массу (в граммах) кристаллогидрата CuSO4 5Н2O, которую необходимо взять
для приготовления 160 г 10 %-ного раствора безводной соли.
6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %-ного раствора
(плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора.
7. Определите массу (в граммах) добавленной воды, необходимой для приготовления
10 %-ного раствора из 1 моль дигидрата гидроксида калия.
8. Установите массу (в граммах) 4 % – ного раствора нитрата калия, приготовленного путем разбавления водой из 20 г 15 %-ного раствора.
9. Рассчитайте, до какого объема (в литрах) надо разбавить водой 700 г 50,5 %-ного раствора ацетата калия, чтобы приготовить 7,7 %-ный раствор с плотностью 1038 г/л.
10. Какой объем (в литрах) воды необходим для разбавления 200 мл 96 %-ного этанола
(плотность 0,8 г/мл) до 10 %-ного спирта?
11. К 100 г 35 %-ного водного раствора метанола добавили 50 г того же вещества. Найдите массовую долю (в %) спирта в конечном растворе.
12. К 250 мл 8% – ного раствора нитрата серебра (I) добавили еще соли и приготовили
16 %-ный раствор. Установите добавленное количество соли (моль).
13. Какой объем (в литрах, н. у.) аммиака надо растворить в 1 л 10 %-ного раствора
(плотность 0,96 г/мл) того же вещества для приготовления 15 %-ного раствора?
14. Определите массовую долю (в %) нитрата натрия в конечном растворе, приготовленным смешиванием 90 г 5%-ного и 120 г 40 %-ного растворов.
15. Какую массу в граммах 96 %-ный серной кислоты надо смешать с 200 г 5%-ный кислоты, чтобы приготовить 20 %-ный раствор?
16. Смешали 250 мл 30 %-ного водного раствора метанола (плотность раствора 0,954 г/мл) и 300 г 40 %-ного раствора того же спирта. Какой станет массовая доля (в %) вещества в конечном растворе?
17. Заполнили колбу вначале хлороводородом (н. у.), затем водой. Какова массовая доля
(в %) вещества в приготовленном растворе?
18. Гидроортофосфат кальция образует 0,02 %-ный насыщенный раствор в комнатных условиях. Найдите минимальный объем (в литрах) воды, требующийся для растворения 100 г соли.
19. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе.
20. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %-ного раствора (плотность 1,24 г/мл).
21. Найдите объем (мл) воды, в котором надо растворить 70 г Fe(NO3)3 9Н2O для приготовления 12 %-ного раствора.
22. Каким количеством воды (моль) надо разбавить 500 мл 20 %-ный азотной кислоты
(плотность 1,12 г/мл), чтобы приготовить 8 %-ный раствор?
23. Разбавлением водой приготовлен 1 кг 3,5 %-ный уксусной кислоты из 70 %-ной (плотность 1,069 г/мл). Найдите объем (мл) исходного раствора кислоты.
24. Приготовили раствор 10 г сахарозы в 200 г воды. Затем раствор упарили вдвое (по объему). Определите массовую долю (в %) углевода в конечном растворе.
25. К 1 л 25 %-ного раствора едкого натра (плотность раствора 1,28 г/мл) добавляют порцию той же щелочи и готовят 35 %-ный раствор. Рассчитайте массу (в граммах) этой порции.
26. Смешали 300 мл 10 %-ный хлороводородной кислоты (плотность 1,05 г/мл) и 100 г 5%-ной кислоты. Определите массовую долю (в %) растворенного вещества в конечном растворе.
27. Водный 5 %-ный раствор нитрата стронция массой 320 г смешали с 45 г 38 %-ного раствора того же вещества. Рассчитайте конечную массовую долю (в %) растворенного вещества.
 |
Ответы
1. 13,9 % КCl. 2. 291 г С2Н5ОН. 3. 160 л НС(Н)O. 4. 14,8 % ZnSO4. 5. 25 г CuSO4 5Н2O. 6.
0,231 л НBr. 7. 468 г Н2O. 8. 75 г раствора KNO3. 9. 4,42 л раствора К(СН3СОО). 10. 1,376 л Н2O.
11. 56,7 % СН3ОН. 12. 0,14 моль AgNO3. 13. 74,41 л NH3. 14. 25 % NaNO3. 15. 39,47 г H2SO4
(конц.). 16. 35,6 % СН3ОН. 17. 0,163 % НCl. 18. 499 л Н2O. 19. 9,11 % СаCl2. 20. 16,61 моль
КОН. 21. 279,4 мл Н2O. 22. 46,67 моль Н2O. 23. 46,77 мл СН3СООН (конц.). 24. 9,09 %
Cl2Н22О11. 25. 196,92 г NaOH. 26. 8,8 % НCl. 27.9,1 % Sr(NO3)2.
 2020-08-05
2020-08-05 168
168






