Раздел 1. «Термодинамика»
Тема 1.1 «Основные законы идеальных газов»
Занятие №1. «Основные понятия и определения. Основные параметры газов»
Термодинамика представляет собой науку о взаимных превращениях различных видов энергии. Она не рассматривает вопросов, связанных с микрофизическим механизмом изучаемых явлений. Основу термодинамики составляют фундаментальные законы природы. Они называются законами или началами термодинамики. Благодаря высокой достоверности и независимости этих законов от свойств конкретных тел термодинамика успешно решает разнообразные задачи технического характера. На основе термодинамики разрабатывают новые и совершенствуют существующие тепловые машины и установки и создают высокоэффективные технологии, обеспечивающие экономнее расходование энергетических и материальных ресурсов. Совокупность инженерных приложений термодинамики образует се раздел, называемый технической термодинамикой.
Идеальные и реальные газы.
Под идеальными понимают такие газы, в которых отсутствуют силы взаимодействия между молекулами, а сами молекулы принимаются за материальные точки, равномерно распределенные и не имеющие объема.
В природе идеальных газов нет. Однако часто встречаются такие реальные газы, н которых силы взаимодействия между молекулами и объемы самих молекул чрезвычайно малы. Такие газы принимают за идеальные.
Наиболее распространенными газами, применяемыми в технике, и которые в теплотехнических расчетах вполне допустимо считать идеальными, являются: кислород, водород, азот, окись углерода, углекислый газ, метан и практически все реальные газы, за исключением водяного пара, можно считать идеальными. Но если водяной пар перегрет и является частью газовых смесей, то его парциальное давление маю, а температура велика. В этом случае он далек от состояния жидкости. Такой пар можно считать идеальным.
В реальных газах в отличие от идеальных существенны силы меж молекулярных взаимодействий, и пренебрегать объемом молекул нельзя. В таких газах молекулы могут сближаться между собой только до некоторого минимального расстояния, гак как между молекулами возникают силы отталкивания. Поэтому можно считать, что свободный для движения удельный объем будет равен v — b, где b — тот наименьший удельный объем, до которого можно сжать газ, а v — удельный объем сосуда. В соответствии с этим длина свободного пробега молекул уменьшается, и давление увеличивается по сравнению с идеальным газом в отношении
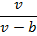
Основными параметрами газов считают: удельный объем о, абсолютное давление р и абсолютную температуру Т.
Переход рабочего тела из одного состояния в другое под влиянием внешних воздействий называют термодинамическим процессом.
Удельный объем v, м3/кг, представляет собой объем единицы массы вещества:
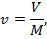
где V — объем, занимаемый веществом, м3; М — масса вещества, кг.
Плотностью ρ, кг/м3, называется величина, обратная удельному объему v:
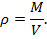
Тогда
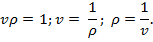
Температура характеризует степень нагретости тела. Это мера средней кинетической энергии тела. Чем больше средняя скорость движения молекул, тем больше температура газа.
Температуру измеряют в двух шкалах: в градусах шкалы Цельсия (°С) и в градусах шкалы Кельвина (К).
В качестве точки отсчета на шкале Цельсия берется так называемая тройная точка состояния воды, для которой характерно существование трех фаз вещества (вода, пар и лёд), находящихся в термодинамическом равновесии. Тройной точке воды соответствует температура 273 К или О °С.
На шкале Кельвина точкой отсчета является температура абсолютного нуля (О К), при которой прекращается тепловое движение молекул.
Между температурами, выраженными в градусах Кельвина и Цельсия, существует зависимость
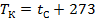
Давление р с точки зрения молекулярно-кинетической теории есть средний результат уларов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, н котором находится газ. Значение давления определяется по следующей формуле:
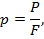
где Р — нормальная составляющая силы, Н; F — площадь поверхности, перпендикулярная к действующей силе, м2.
В системе СИ за единицу давления принят Паскаль (Па), 1 Па — 1 Н/м2. Существуют и внесистемные единицы давления: 1 бар = 1 атм = 105 Па = 760 мм рт. ст. = 10 200 мм вод. ст.
Давление бывает: абсолютное, манометрическое, атмосферное, или барометрическое, и вакуумметричсское. Эти давления связаны следующими выражениями:


где р абс — абсолютное давление; р ман — манометрическое давление; р бар = р атм — барометрическое или атмосферное давление; р вак — вакуумметрическое давление.
Вопросы и задания:
1. Что представляет собой «Термодинамика»?
2. Что разрабатывают на основе термодинамики?
3. Что такое «идеальный газ»?
4. Какие газы допустимо считать идеальными?
5. Чем реальные газы отличаются от идеальных?
6. Что такое термодинамический процесс?
7. Что такое удельный объем? Дать развернутый ответ с формулой.
8. Что такое плотность? Дать развернутый ответ с формулой.
9. Что такое степень нагретости?
10. В каких шкалах измеряется температура?
11. Какова зависимость между температурами, выраженными в градусах Кельвина и Цельсия?
12. Что такое давление р с точки зрения молекулярно-кинетической теории? Дать развернутый ответ с формулой.
13. Какое бывает давление?
 2020-09-28
2020-09-28 4472
4472