Тема: Ряд напряжений металлов
Электрохимический ряд напряжений металлов (ряд Бекетова)
Электрохимический ряд напряжений металлов опытным путем установил Алессандро Вольта, на тот момент он выглядел следующим образом: Zn, Pb, Sn, Fe, Cu, Ag, Au. Величина электродного потенциала зависела оттого, насколько далеко отстояли друг от друга члены ряда. Но причина этого была неизвестна. В 1853 г. русский учёный Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему «Исследование над явлениями вытеснения одних элементов другими». В этой работе он обобщил различные исследования способности одних металлов вытеснять другие из растворов их солей.
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили об ином. Непонятно было и то, как связан «вытеснительный ряд» с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец — из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физико-химик Вальтер Нернст (1864-1941). Вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных электронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li+ | -3,05 |
| K | 1e | K+ | -2,925 |
| Rb | 1e | Rb+ | -2,925 |
| Cs | 1e | Cs+ | -2,923 |
| Ba | 2e | Ba2+ | -2,91 |
| Sr | 2e | Sr2+ | -2,89 |
| Ca | 2e | Ca2+ | -2,87 |
| Na | 1e | Na+ | -2,71 |
| Mg | 2e | Mg2+ | -2,36 |
| Al | 3e | Al3+ | -1,66 |
| Mn | 2e | Mn2+ | -1,18 |
| Zn | 2e | Zn2+ | -0,76 |
| Cr | 3e | Cr3+ | -0,74 |
| Fe | 2e | Fe2+ | -0,44 |
| Cd | 2e | Cd2+ | -0,40 |
| Co | 2e | Co2+ | -0,28 |
| Ni | 2e | Ni2+ | -0,25 |
| Sn | 2e | Sn2+ | -0,14 |
| Pb | 2e | Pb2+ | -0,13 |
| Fe | 3e | Fe3+ | -0,04 |
| H2 | 2e | 2H+ | 0,00 |
| Cu | 2e | Cu2+ | 0,34 |
| Cu | 1e | Cu+ | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag+ | 0,80 |
| Hg | 2e | Hg2+ | 0,85 |
| Pt | 2e | Pt2+ | 1,20 |
| Au | 3e | Au3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25°С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Задание
1.Запишите свойства ряда напряжений металлов. Для каждого свойства подберите в качестве примера по 2 уравнения химических реакций, подтверждающих это свойство.
2.По тексту практической работы заполните таблицу. Если заполнение 2 столбика таблицы вызовет затруднения, то можете его не заполнять. 1 столбик заполняете из текста заданий для 3 опытов, в 3 столбике записываете возможные уравнения реакций, в 4 столбике записываете выводы, используя текст методического обоснования работы.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Взаимодействие металлов с растворами кислот и солей
Цель работы: закрепить знание свойств электрохимического ряда напряжений металлов
Приборы и реактивы, необходимые для опытов:
1)штатив с пробирками;
2) градированная пробирка;
3) металлы: цинк, железо, медь;
4) растворы сульфата меди, хлорида железа, хлорида (сульфата) цинка;
5) растворы серной и соляной кислот (1:5)
Теоретическое обоснование работы
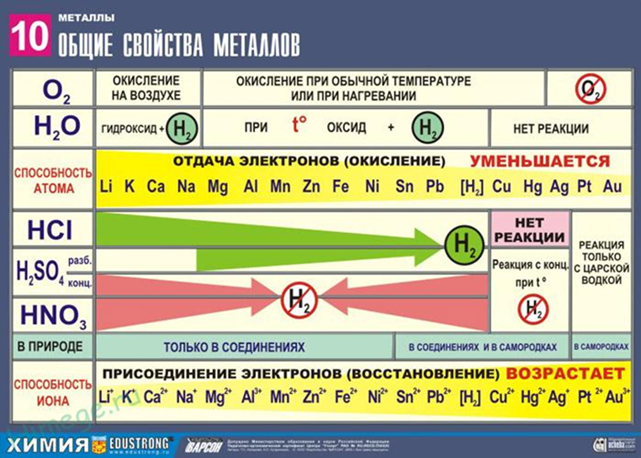
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.

Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот - неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
Порядок выполнения работы
1. В пробирки с цинком и железом добавьте 1 мл соляной кислоты, в пробирку с медью – 1 мл разбавленной серной кислоты. Какие происходят изменения в каждой из пробирок?
2. Налейте в одну пробирку 1 мл раствора сульфата меди, в другую – столько же раствора хлорида (сульфата) цинка. В первую пробирку опустите гранулу цинка, во вторую – кусочек меди. Через 3 минуты установите, в какой из пробирок произошли изменения.
3. Налейте в одну пробирку 1 мл раствора сульфата меди, в другую – столько же раствора хлорида железа. Наклонив первую пробирку, опустите в нее железный стержень или гвоздь, во вторую пробирку опустите кусочек меди.
Через 3 минуты установите, в какой из пробирок произошли изменения.
Результаты опытов занесите в таблицу
| Реактивы опыта | Наблюдения | Уравнения химических реакций | Вывод |
 2020-09-24
2020-09-24 640
640






