Подготовка к ВПР
(В конце каждого задания есть образец рассуждений)
1. Используя Периодическую систему, заполнить таблицу, посчитать Молярную массу следующих веществ:


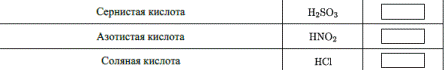
Как решать: в формуле вещества вместо химических символов подставляем Атомные массы элементов, умножая на число атомов элемента:
М(СН4) = 12 + 1∙4 = 16 г/моль
М(НNO2) = 1+ 14 + 16∙2 = 47 г/моль
2.
А)


Б)

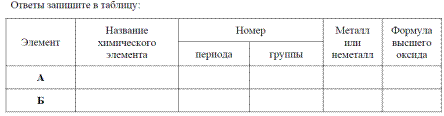
В)
Как решать:
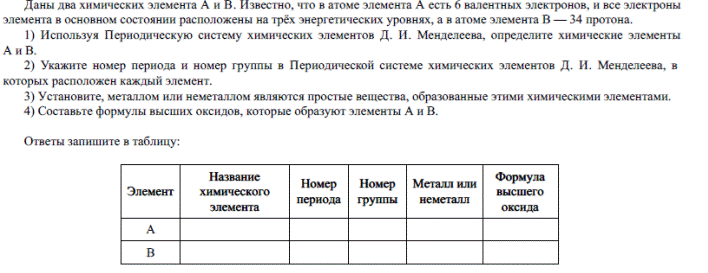
Порядковый номер элемента показывает заряд ядра атома, число протонов в ядре, число электронов в атоме. Валентными называют электроны внешнего энергетического уровня (номер группы, в которой находится элемент). Число энергетических уровней = номер периода, в котором находится элемент. Высшими называются оксиды, в которых элемент проявляет высшую степень окисления = номеру группы, в которой он находится.
В задании А:
Элемент А. 15ē = порядковый номер 15 = фосфор Р, 3 период, 5 группа, неметалл, высший оксид Р2О5
Элемент Б. 15:5=3ē, порядковый номер 3 = литий Li, 2 период, 1 группа, металл, высший оксид Li2O.
В задании Б:
Элемент А. 16ē = порядковый номер 16 = сера S, 3 период, 6 группа, неметалл, высший оксид SO3
Элемент Б. 20 р+ = порядковый номер 20 = кальций Са, 4 период, 2 группа. Металл, высший оксид СаО
В задании В:
Элемент А – 6 группа, 3 период = сера S, 3 период, 6 группа, неметалл, высший оксид SO3
Элемент В – порядковый номер 34 = селен Se, 4 период, 6 группа, неметалл, высший оксид SеO3
Массовая доля вещества в смеси.
ω (вещества) = 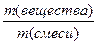 ;
;
m(вещества) = m (смеси)∙ ω (вещества)
массовую долю из % переводим в доли от 1, поделив на 100, например,
10% = 0,1
2,7 % = 0,027
56% = 0,56
А.


Б.


В.
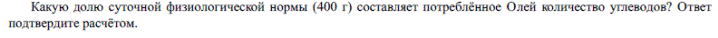
Как решать:
Задание А.
ω(соли)=  = 0,011∙ 100%= 1,1%; Настя отдыхала на Азовском море.
= 0,011∙ 100%= 1,1%; Настя отдыхала на Азовском море.
m(соли)= 250∙ 0,026 = 6,5г – масса соли из воды Мраморного моря.
2,6% = 0,026
Задание Б.
m(жира) = 60∙ 0,67= 40,2 г – получил организм юноши
67% = 0,67
ω (от нормы)= 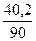 = 0,4467 ∙ 100% = 44,67%
= 0,4467 ∙ 100% = 44,67%
Задание В.
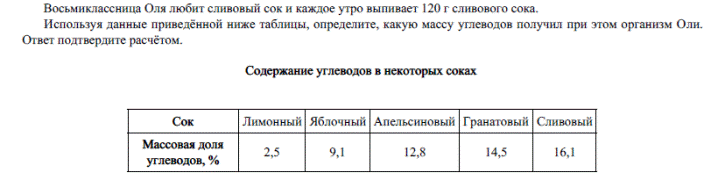
m (углеводов) = 120 ∙ 0,161 = 19,32 г – масса углеводов
16,1% = 0,161
ω (от нормы)= 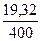 =0,0483 ∙ 100% = 4,83%
=0,0483 ∙ 100% = 4,83%
Классы неорганических соединений (ПОВТОРИЛИ ВСЕ)
А.


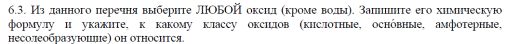

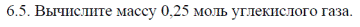
Б.



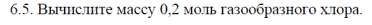
Как решать:
Напоминаю, как найти массу вещества (m), если известно его количество (n).
Формула:
n = 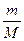 ’ отсюда: m= n∙M, М – молярная масса вещества, считаем по Периодической системе.
’ отсюда: m= n∙M, М – молярная масса вещества, считаем по Периодической системе.
Задание А: m (CO2) = 0,25 моль ∙ 44 г/моль = 11 г
углекислый газ
Задание Б: m (Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г
газообразный хлор
Химические уравнения.
А.


Ответ: рис. 2, выпаривание.
Б.
Ниже даны описания двух химических превращений с участием веществ:
(1) алюминий + кислород → оксид алюминия
(2) карбонат кальция + азотная кислота → нитрат кальция + углекислый газ + вода
Составьте уравнения реакций, используя химические формулы, определите тип реакций.
С помощью какого метода разделения смесей можно разделить взвесь карбоната кальция в воде? (рис.1, ответ фильтрование)
 2020-10-10
2020-10-10 174
174






