Тема 3-4. Валентные состояния атома углерода
Инструкция для студентов:
1. Изучить предоставленный по теме материал
Строение атома углерода
Атом углерода как элемент главной подгруппы IV группы имеет четыре валентных электрона, что отражает электронная формула 2s22р2 или графическая формула:
2.
Очевидно, что атом углерода может быть двухвалентным, образуя две ковалентные связи за счет двух неспаренных электронов по механизму обобществления (спаривания) электронов.
возбужденное состояние атома углерода
Известно, что атом углерода может проявлять валентность II (например, в CO или CH2 (карбен)) и IV (CH4, CO2). И в подавляющем большинстве соединений атом углерода четырех валентный. Это объясняется тем, что в таких соединениях, в том числе во всех органических, атом углерода находится в возбужденном состоянии (СС∗)::
С 2s22р2 → С 2s12р3
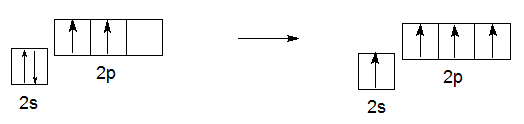
Переход в возбужденное состояние связан с некоторыми энергетическими затратами (примерно 360 кДж/моль), однако эти затраты полностью окупаются при образовании четырех ковалентных связей. Так, при образовании четырех связей С–Н выделяется 1640 кДж/моль.
В возбужденном состоянии все четыре электрона на внешнем уровне - неспаренные, и углерод может образовывать четыре ковалентные связи, отдавая по одному электрону на образование обобществленной пары, т.е. ковалентной связи (КС). Несмотря на то, что неспаренные электроны находятся на разных подуровнях, связи, которые образуют эти электроны - равноценны. Это объясняется явлением, которое называется гибридизацией (см. тему "Гибридизация атома углерода")
Валентность IV атом углерода имеет в соединениях CH4, CF4, CO2, H2CO3, CH3OH и многих других:
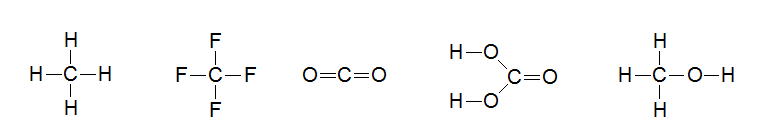
Кроме валентности II и IV углерод может проявлять и валентность III. Так, атом углерода образует три ковалентные связи в молекуле СО — в оксиде углерода (II). Это возможно за счет одной вакантной атомной 2р-орбитали. Рассмотрим еще раз электронную конфигурацию валентных электронов атома углерода в основном состоянии:
3. 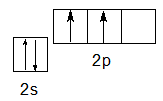
Атом углерода может образовать две ковалентных связи по механизму спаривания электронов (за счет двух неспаренных электронов на р-подуровне) и еще одну связь — по донорно-акцепторному механизму (является акцептором за счет вакантной р-орбитали):
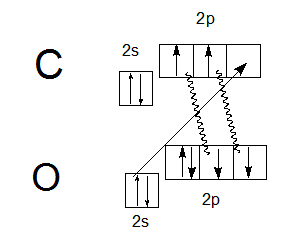
На этой схеме две ковалентные связи, обозначенные волнистыми линиями, образованы по механизму спаривания (за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода), в то время как третья ковалентная связь, изображенная прямой стрелкой, образована по донорно-акцепторному механизму (атом кислорода — донор электронной пары, атом углерода — акцептор). Следовательно, валентность углерода в молекуле СО равна III. Отсюда становится понятной современная структурная формула молекулы СО, отражающая ковалентность углерода, равную III:
4. 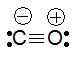
В этой формуле знаки «−» и «+» называются формальными зарядами, они показывают, что одна из связей образована по донорно-акцепторному механизму, причем электронная пара переходит с орбитали атома кислорода (поэтому на кислороде «+») на орбиталь углерода (поэтому на углероде «−»).
Следовательно, атом углерода может проявлять валентности (ковалентности), равные II, III и IV (последняя предпочтительней).
2.Просмотреть видеоурок https://youtu.be/UVNVQCooDC4
3.Ответить на вопросы:
Задание 1. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы которых записаны.
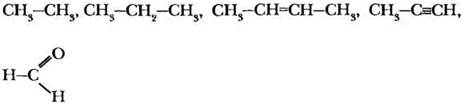
Задание 2. За счет перекрывания орбиталей какого типа образованы все ковалентные связи в молекулах следующих веществ.
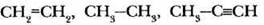
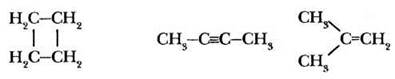
Задание 3. Какой тип гибридизации не существует и почему: sp-, sp2-, sp3-, sp4?
Задания отправить вк личным сообщением до 21.00 11.09.20
 2020-10-11
2020-10-11 2355
2355