Лекция 5
Золь-гель технологии
Стадийная схема формирования гидроксидов при осаждении
Независимо от природы получаемых гидроксидов, этапы их формирования до стадии старения являются общими.
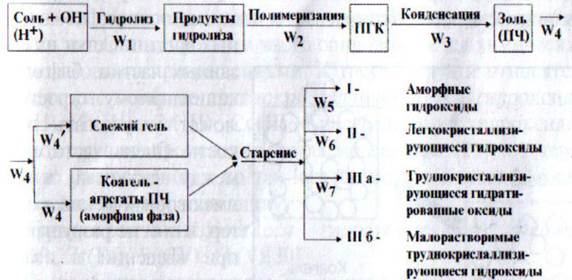
Рис. 1. Стадийная схема формирования гидроксидов при коллоидно-химическом осаждении.
Первой стадией процесса является гидролиз, протекающий при увеличении рН среды за счет добавления к раствору соли щелочного осадителя или при уменьшении рН путем добавления кислоты к алюминатам или силикатам щелочных металлов. Продукты гидролиза могут подвергаться быстрой полимеризации и конденсации с образованием относительно устойчивых частиц золя, которые можно рассматривать как первичные элементы (частицы) осадка. Разница лишь в наличии или отсутствии стадии полимеризации при формировании некоторых гидроксидов. Считается, что эта стадия характерна для гидроксидов со степенью окисления катионов больше 2+ (Al3+, Cr3+, Fe3+, Si4+, Ti4+, Zr4+). Для гидроксидов со степенью окисления катионов меньше или равной 2+ типично образование моно- и биядерных комплексов (Ag+, Zn2+, Mg2+). Исключение из этого правила наблюдается для раствора Cu2+: в зависимости от рН раствора в них могут образовываться как моноядерные, так и полиядерные гидроксокомплексы.
Образовавшиеся частицы золя гидроксида со временем теряют свою агрегативную устойчивость и коагулируют. В зависимости от условий может происходить гелеобразование или образование коагеля. Направление процесса в сторону образования геля или коагеля определяется различиями в скоростях гидролиза и коагуляции. Если скорость гидролиза больше скорости коагуляции последовательно протекают стадии гидролиза, образование золя и гелеобразования. Необходимым условием для формирования геля является использование в качестве осадителя сильного гидролизующего реагента, но слабого коагулятора. Образование геля представляет собой связывание отдельных частиц золя в разветвленные цепочки, которые целиком заполняют объем. Поэтому не наблюдается повышение концентрации твердых частиц в любой выбранной области системы. Вместо этого вся среда становится вязкой, а затем затвердевает в сетку, состоящую из связанных частиц. Сетка из связанных частиц, благодаря капиллярному строению, может удерживать жидкость. Часто связи между частицами в геле имеют химический характер, и они не разрушаются при введении в осадок пептизаторов. Если скорость коагуляции больше или равна скорости гидролиза, образование золя и его коагуляция протекают одновременно.
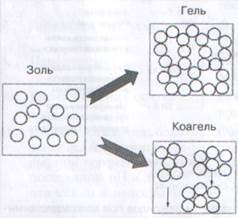
Рис. 2. Схематическое изображение образования геля и коагеля из золя.
Наилучшие условия образования коагеля – это использование в качестве осадителя слабого гидролизующего агента, но сильного коагулятора. При формировании коагеля образуются отдельные агрегаты первичных частиц. Концентрация твердого вещества в агрегатах выше, чем в исходных золях. В зависимости от природы осадка и условий его получения плотность упаковки первичных частиц в агрегатах может существенно различаться. Однако в целом коагуляционные связи между частицами в агрегатах непрочны. По этой причине осадок при механическом воздействии или при введении пептизатора может снова превращаться в золь.
Особенностью первичных частиц, как в гелях, так и гоагелях, является то, что они обладают значительным избытком свободной энергии, делающей их способными к дальнейшим превращениям. При старении осадков протекают различные физические и химические процессы, приводящие к укрупнению частиц, их кристаллизации, изменению фазового состава. По способности к кристаллизации гидроксиды можно разделить на три группы:
1. Аморфный практически не кристаллизующийся силикагель – SiO2.
2. Легко кристаллизующиеся гидроксиды Mg(ОН)2, Cd(ОН)2, Zn(ОН)2, Sn(ОН)2, входящие во вторую группу, кристаллизуются настолько быстро, что аморфную фазу удается наблюдать лишь в особых условиях.
3. Кристаллизация аморфных соединений этой группы протекает сравнительно медленно, при этом часто сопровождается химическими и фазовыми превращениями.
3а) Труднокристаллизующиеся гидратированные оксиды TiO(OH)2, SnO2 nH2O,
ZrO2 nH2O, SbO2 nH2O.
3б) Малорастворимые труднокристаллизующиеся гидроксиды Al(OH)3, AlOOH, FeOOH, Cu(OH)2, Cr(OH)3.
Следует отметить, что к легкокристаллизующимся относятся гидроксиды, процесс формирования которых идет через образование только моно- и биядерных комплексов, а формирование аморфных и труднокристаллизующихся гидроксидов сопровождается образованием полиядерных гидроксокомплексов.
Приготовление катализаторов по золь - гель технологии
В последние годы большой прогресс был достигнут в области развития так называемого золь – гель способа получения дисперсных одно- и многокомпонентных систем путем гидролиза растворов солей и алкоксидов металлов. В основе метода лежат фундаментальные положения, выявленные при изучении закономерностей образования гидроксидов.
- стадийный механизм формирования гидроксидов;
- зависимость скоростей каждой из стадий от условий и параметров осаждения;
- определяющее влияние соотношений скоростей различных стадий на конечные свойства осадка и будущего катализатора.
Большой интерес к золь – гель технологии объясняется возможностью взаимосвязанного управления составом и микроструктурой пористого тела на молекулярном уровне и формовании материала в порошки, волокна, тонкие пленки, гранулы различного размера и формы. Помимо приготовления пористых каталитических материалов, получаемых в виде ксерогелей, золь-гель метод используется для получения аэрогелей – уникальных высокопористых материалов. Аэрогели представляют собой прозрачные монолиты с пористостью до 99,8%.
В качестве исходных веществ для золь-гель метода используются как неорганические соли (Na2SiO3, SiCl4, TiCl4, ZrCl4 и др.), так и алкоксиды (Si, Al, Ti и др.), например: тетраэтоксисилан, тетрабутоксисилан, изопропилат циркония и др. Золь-гель способом с использованием алкоксидов получают широкий набор дисперсных материалов различного химического состава:
- индивидуальные оксиды (кремния, алюминия, титана, циркония, и др.);
- бинарные и многокомпонентные оксиды (кремния-титана, церия-циркония, алюминия-титана);
- нанесенные оксидные и металлические катализаторы (платина на оксиде кремния, алюминия, оксид церия на оксиде алюминия).
Применение в качестве исходных веществ алкоксидов по сравнению с неорганическими солями имеет ряд преимуществ, так обеспечивается:
- высокая степень чистоты конечных продуктов;
- надежное регулирование параметров процесса, определяющих конечную структуру алкогеля и его свойства;
- однородность химических, физических и морфологических свойств продукта;
- возможность готовить образцы при низких температурах;
- возможность введения различных компонентов в одну стадию;
- возможность контролировать кинетику реакции и стабилизировать матастабильные системы.
Процесс формирования пористого материала по золь-гель технологии состоит из следующих стадий:
1. Гидролиз раствора исходного вещества.
2. Поликонденсация продуктов гидролиза с образованием низкомолекулярных комплексов.
3. Образование первичных частиц золя и рост глобул золя.
4. Гелеобразование.
5. Старение геля.
6. Сушка геля.
Рассмотрим некоторые стадии процесса на примере получения силикагеля.
Гидролиз. Выбор гидролизующего агента зависит от природы исходных веществ. Гидролиз алкоксидов осуществляют в водных растворах родственных спиртов с минеральными кислотами или основаниями:
(RO)3Si-OR + 4HOH «(HO)3Si-OH + 4ROH.
Скорость гидролиза зависит от нескольких параметров, важнейшим из которых является рН.

Рис. 3. Зависимости скорости гидролиза и конденсации тетраэтоксисилана от рН.
Нибольшая скорость гидролиза достигается при высоких и низких рН, а минимальная при рН=7. В кислых условиях происходит протонирование алкоксидной группы, в результате чего образуется легко уходящая группировка ROH:
ºSi-OR + H+ «ºSi-HOR+,
ºSi-HOR+ + H2O «ºSi-HOH+ + ROH,
ºSi-HOH+ «ºSi-OH + H+.
В щелочных условиях в растворе существует сильный нуклеофил ОН-, который может атаковать алкосилановую группу:
ºSi-OR + OH- «ºSi-O- + ROH,
ºSi-O- + H2O «ºSi-OH + OH-.
Скорость гидролиза можно варьировать алкильной группы. Так, в ряду тетраметоксисилан – тетраэтоксисилан- тетрапрпоксисилан- татрабутоксисилан она уменьшается. Скорость гидролиза можно контролировать, изменяя мольное соотношение между добавленной водой и алкоксисиланом. Для полного гидролиза это соотношение варьируется от 4 до 20. При отношении, равном 1, образуются частично гидролизованные формы, которые могут долгое время храниться в кислом растворе без поликонденсации.
Реакции поликонденсации приводят к образованию силоксановых связей и побочных продуктов – спирта и воды, и описываются следующими уравнениями:
- образование димеров (НО)3Si-OH + HO-Si(OH)3 «(НО)3Si-O- Si(OH)3 + HOH,
(RО)3Si-OR + HO-Si(OR)3 «(RО)3Si-O- Si(OR)3 + ROH,
(НR)3Si-OH + HO-Si(OR)3 «(RО)3Si-O- Si(OR)3 + HOH$
- образование линейных тримеров и тетрамеров;
- замыкание тетрамеров в кольцо;
- присоединение мономеров к высокомолекулярным соединениям до образования первичных частиц золя.
Процесс конденсации является конкурентным гидролизу и также зависит от рН, но эта зивисимость имеет более сложный характер (рис. 3).Процесс конденсации может ускоряться как в кислых, так и в щелочных условиях. Реакции поликонденсации и гидролиза обычно протекают в системе практически одновременно, и конечное состояние системы определяется соотношением между скоростями этих реакций.
Рассмотрим пути протекания реакций гидролиза и поликонденсации до начала формирования геля. В кислых растворах скорость гидролиза превышает скорость поликонденсации. Гидролиз протекает быстро, в системе образуется большое количество монокремниевой кислоты, вследствие чего интенсивно протекает процесс зародышеобразования. Поликонденсация протекает медленнее, что приводит к формированию большого количества мелких частиц золя размером 2-3 нм. В щелочных растворах скорость конденсации превышает скорость гидролиза, в системе не создается пересыщение, необходимое для интенсивного зародышеобразования, поэтому происходит только рост уже имеющихся зародышей и формирование крупных частиц золя размером с десятки нанометров. Образующийся гель является сильно разветвленным и содержит в себе коллоидные агрегаты. В нейтральных условиях образуются как крупные, так и мелкие агрегаты.
Гелеобразование. Основная стадия в процессе образования геля – столкновение двух частиц золя, обладающих достаточно низким зарядом на поверхности. Процесс превращения золя в однородный гель происходит через образование силоксановых связей между поверхностными группами золя по реакции конденсации:
ºSi-OH + HO-Siº ® ºSi-OSiº + H2O.
Этот процесс приводит к необратимому связыванию частиц. Скорость гелеодразования зависит от рН, концентрации и размеров золя SiO2, температуры, содержания электролитов и органических жидкостей.
Суммируя протекающие в системе процессы гидролиза, поликонденсации и гелеобоазования, можно выделить несколько возможных вариантов получения ксерогелей с различными текстурными характеристиками (рис. 4).
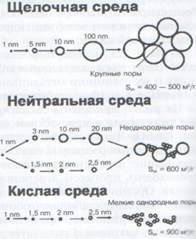
Рис. 4. Влияние рН коллоидного раствора на формирование геля SiO2.
- При протекании реакции в кислой среде образуется однородный тонкопористый силикагель, состоящий из мелких первичных частиц с удельной поверхностью до 900 м2/г.
- При протекании реакции в щелочных условиях получается крупнопористый силикагель, состоящий из частиц большого размера (4-6 нм). Удельная площади поверхности варьируется в пределах 400-500 м2/г.
- При синтезе в нейтральной среде происходит образование разнородного пористого силикагеля.
Сушка алкогеля. Существует несколько вариантов сушки, остановимся на наиболее распространенных.
При стандартной сушке силикагелей на воздухе по периметру сетки геля появляются мениски и возникает граница раздела фаз твердое – жидкое - газ. Это ведет к возникновению сил, стремящихся сжать сетку геля, что приводит к резкому уменьшению объема пор.
При высокотемпературной сушке в сверхкритических условиях алкогель с орагинческим растворителем помещается в автоклав, в котором температура и давление повышаются до сверхкритического значения для данного растворителя (7-8 атм, 250°С для этанола и метанола). Растворитель переходит в состояние флюида, который может покинуть структуру геля, не разрушая ее. Такой метод удаления растворителя широко используется для получения аэрогелей.
В последнее время все большую популярность приобретает метод низкотемпературного удаления растворителя в сверхкритических условиях. Растворитель в поровом пространстве замещается на негорючую жидкость с более низкой критической температурой. Обычно это СО2, который продувают через алкогель при температуре 10°С и возрастающем давлении до тех пор, пока весь органический растворитель не будет удален. Затем повторяется процедура удаления СО2 в критических условиях (Т = 31°С, Р = 7,29 атм). Гели, высушенные в низкотемпературных условиях, лучше сохраняют структуру алкогеля.
 2020-10-12
2020-10-12 170
170






