Самовоспламенение по цепному механизму с образованием холодных пламен происходит редко, в основном при пониженном давлении, и не сопровождается резким повышением температуры реагирующей смеси. Цепной механизм учитывает только химическую сторону процесса, тогда как
при горении выделяется большое количество теплоты, что оказывает существенное влияние на протекание процесса.
Поместим в герметичный сосуд объемом V и с температурой стенок Т0 горючую газовоздушную смесь с температурой Т. В смеси начнутся реакции окисления со скоростью:
W = k0 Cropn С0КР exp(-E/RT) (17)
где к0 - константа скорости реакции;
С г0р, С0к -концентрация горючего и кислорода, молъ/м3;
Е - энергия активации, Дж/моль;
R - универсальная газовая постоянная, Дж/моль К;
п, (3 - стехиометрические коэффициенты при горючем и окислителе в уравнении реакции горения.
Выделяющаяся теплота (q+) будет расходоваться на нагрев смеси и рассеиваться в окружающую среду:
q+ = QpoP-W-V (18),
где Qeop - тепловой эффект реакции, кДж/моль;
V - объем сосуда, м3, или
q+ = Qrop-V-k0-Crop-COK-exp(-E/RT) (19)
Получим аналогичное выражение для процесса теплоотвода (q) через стенки реакционного сосуда. Пусть температура смеси Т будет выше температуры стенки Т0: Т > Т0. В этом случае смесь будет отдавать теплоту стенке, и вычислить такой тепловой поток можно по формуле Ньютона:
q~= а (Т-Т0) (20),
где а - коэффициент теплоотдачи, кДж/м2 К
С учетом обшей поверхности сосуда S получается следующее выражение для расхода теплоты:
q~=a(T-T0)-S (21)
Анализ выражений (19) и (21) показывает, как и почему будет меняться тепловое состояние системы в зависимости от температуры стенки сосуда и температуры горючей смеси. Графически q+ представляет собой экспоненциальную зависимость, а q - прямую линию (рис.3). Рассмотрим состояние системы при температуре стенки T0i = const. Пусть Т будет меньше T0i (начало графика). Здесь приход теплоты выше расхода, т.е. q+ > q, поэтому смесь будет нагреваться, и в точке А установится равновесие. В этой точке, естественно, химическая реакция продолжается, но при малейшем повышении температуры смеси система вновь вернется в эту
точку, поскольку там (справа от точки А) расход теплоты выше прихода.ДТри
Нг
смещении влево система опять же вернется в точку А, поскольку здесь наоборот приход теплоты больше расхода. Таким образом, в точке А система находится в состоянии устойчивого равновесия, и реакция будет протекать без воспламенения до полного расходования компонентов.
Повысим температуру стенок сосуда до Т0г: прямая теплоотвода сместится параллельно самой себе вправо, и кривая тепловыделения будет касаться ее в единственной точке С. Сначала горючая смесь будет нагреваться от температуры ТА до Тс, система перейдет в точку С, установится равновесие (q+ = q). При малейшем увеличении температуры смеси выше Тс (смещение по оси температур вправо) тепловыделение будет превышать теплоотвод. Поэтому смесь будет стремительно, по экспоненциальному закону, нагреваться до самовоспламенения - произойдет тепловой взрыв. Следовательно, температура стенки Т02, для которой прямая отвода теплоты - касательная к кривой тепловыделения, является предельной для существования стационарного режима. Условием теплового самовоспламенения является неравенство q+ > q. Как видно из рисунка, Т02 несколько ниже истинной температуры самовоспламенения Тс. Для саморазогрева горючей смеси от температуры Т02 до Тс необходимо время, которое называется индукционным периодом теплового самовоспламенения.
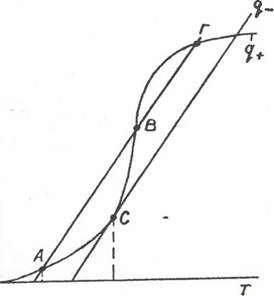 Tot тог Г° Рис.3. Тепловыделение q и теплоотвод q при химической реакции смеси в сосуде объемом V. Tot тог Г° Рис.3. Тепловыделение q и теплоотвод q при химической реакции смеси в сосуде объемом V. |
Величина индукционного периода в ряде случаев достигает пяти и более секунд. Следует отметить, что реальные системы находятся либо под атмосферным, либо под повышенным давлением. Поэтому в них не реализуется в чистом виде только цепной или только тепловой механизм самовоспламенения. На практике в большинстве случаев механизм самовоспламенения смешанный, цепочечно-тепловой, но рассмотренные здесь закономерности остаются справедливыми и для такого смешанного механизма.
 2014-02-02
2014-02-02 2210
2210
