Все реакции образования комплексов в водном растворе обратимые:
M + n L «[MLn],
где M - комплексообразователь; n L – определенное число лигандов; [MLn] - образовавшийся комплекс.
Состояние равновесия при Т = соnst для реакции образования комплекса [MLn] по закону действующих масс количественно характеризуется общей константой устойчивости βn (константа образования комплекса):
βn = 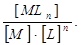 (5.1)
(5.1)
где [MLn], [M], [L]n - равновесные молярные концентрации соответствующих форм.
Константа βn(уст.) определяет меру общей устойчивости комплекса [MLn] по отношению к устойчивости аквакомплекса [M(H2O)n], поскольку имеет место обратимая реакция обмена лигандов:
 2014-02-02
2014-02-02 795
795








