Середня кінетична енергія поступального руху молекул ідеального газу залежить тільки від його абсолютної температури, 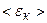 прямо пропорційна до Т:
прямо пропорційна до Т:
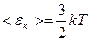
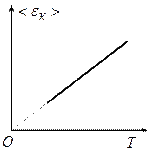 На рисунку зображено залежність
На рисунку зображено залежність 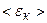 від
від 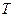 . Якщо
. Якщо 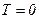 ,
, 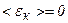 , тобто припиняється поступальний рух молекул газу, а отже, дорівнює нулю і його тиск.
, тобто припиняється поступальний рух молекул газу, а отже, дорівнює нулю і його тиск.
Абсолютна температура є мірою середньої кінетичної енергії поступального руху молекул.
Однак в області температур, близьких до абсолютного нуля, поведінка молекул описується не класичними законами, а законами квантової механіки.
Лекція 2. Елементи статистичної фізики.
1. Розподіл молекул ідеального газу за їхніми швидкостями.
2. Барометрична формула, розподіл Больцмана.
3. *Зіткнення молекул, середня довжина вільного пробігу молекул.
4. *Поведінка газів за умов низького тиску.
5. *Вакуумна техніка.
1. Розподіл молекул ідеального газу за їхніми швидкостями.
Через хаотичний рух молекул та їх взаємні зіткнення, швидкість кожної молекули постійно змінюється як за величиною, так і за напрямом. В газі будуть як швидкі, так і повільні молекули. Хоча швидкості окремих молекул змінюються, властивості газу в цілому у стані термодинамічної рівноваги (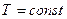 ) не змінюються, тобто макропараметри системи (
) не змінюються, тобто макропараметри системи (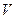 ,
, 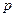 ) залишаються сталими.
) залишаються сталими.
Дж. Максвелл теоретично розв’язав задачу про розподіл молекул ідеального газу за швидкостями поступального руху. Він встановив закон, що дає змогу визначити, яка кількість молекул 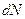 із загальної кількості
із загальної кількості 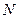 молекул ідеального газу мають при даній температурі швидкості, що лежать в інтервалі від
молекул ідеального газу мають при даній температурі швидкості, що лежать в інтервалі від 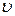 до
до 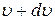 .
.
Дж. Максвелл припускав, що газ складається з великої кількості n однакових молекул, температура в усіх частинах посудини з газом стала і зовнішні дії на газ відсутні.
Якщо температура газу не змінюється, то характер розподілу молекул за швидкостями знаходиться у стані рівноваги, тобто встановлюється стаціонарний незмінний у часі процес, що описується статистичним законом. Цей закон вперше отримав Дж. Максвел:
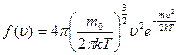 – розподіл Максвела,
– розподіл Максвела,
де 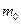 – маса молекули,
– маса молекули,
k – стала Больцмана 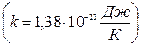 ,
,
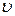 – швидкість молекули,
– швидкість молекули,
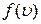 – функція розподілу молекул за швидкостями, яка дозволяє визначити кількість молекул, швидкість яких лежить в інтервалі від
– функція розподілу молекул за швидкостями, яка дозволяє визначити кількість молекул, швидкість яких лежить в інтервалі від 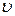 до
до 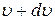 :
:
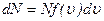 .
.
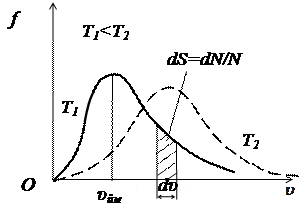
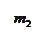
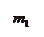 На рисунку наведено графік функції розподілу молекул за швидкостями
На рисунку наведено графік функції розподілу молекул за швидкостями 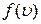 . Функція
. Функція 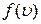 зростає від нульового до максимального значення, а потім асимптотично спадає до нуля. Крива несиметрична відносно максимального значення
зростає від нульового до максимального значення, а потім асимптотично спадає до нуля. Крива несиметрична відносно максимального значення 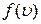 . Максимум функції
. Максимум функції 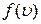 залежить від температури
залежить від температури 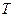 і роду газу
і роду газу 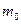 . При збільшенні температури (або зменшенні маси молекул) максимум кривої
. При збільшенні температури (або зменшенні маси молекул) максимум кривої 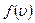 зміщується у бік більших швидкостей, а його абсолютна величина зменшується, причому площа, яка охоплена кривою
зміщується у бік більших швидкостей, а його абсолютна величина зменшується, причому площа, яка охоплена кривою 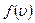 і віссю
і віссю  , залишається незмінною.
, залишається незмінною.
Відносна кількість молекул 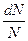 , швидкості яких лежать в інтервалі від
, швидкості яких лежать в інтервалі від  до
до 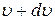 , чисельно дорівнює площі заштрихованої ділянки на рисунку.
, чисельно дорівнює площі заштрихованої ділянки на рисунку.
Швидкість 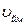 , яку мають найбільша кількість молекул за даної температури називають найбільш ймовірною швидкістю.
, яку мають найбільша кількість молекул за даної температури називають найбільш ймовірною швидкістю.
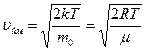 ,
,
оскільки
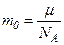 ,
, 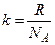 .
.
Середня арифметична швидкість молекул 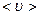 визначається за формулою:
визначається за формулою:
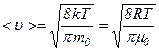 .
.
Отже, є три швидкості, які характеризують стан газу:
Найбільш ймовірна швидкість 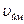 | Середня арифметична швидкість 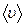 | Середня квадратична швидкість 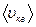 |
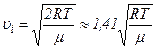 | 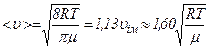 | 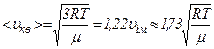 |
2. Барометрична формула, розподіл Больцмана.
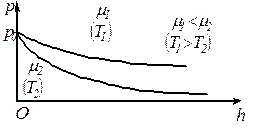 За відсутності дії зовнішніх сил, молекули рівномірно розподіляються по всьому об’єму посудини. Молекули будь-якого газу завжди перебувають в полі сил тяжіння Землі. Якщо б не було гравітаційного тяжіння, то молекули повітря земної атмосфери розсіялися по всьому Всесвіту. Але якщо молекули повітря земної атмосфери не перебували б у тепловому русі, то всі вони “впали” б на Землю. Тяжіння i тепловий рух приводять до стаціонарного стану газу, при якому його тиск i концентрація зменшується з висотою.
За відсутності дії зовнішніх сил, молекули рівномірно розподіляються по всьому об’єму посудини. Молекули будь-якого газу завжди перебувають в полі сил тяжіння Землі. Якщо б не було гравітаційного тяжіння, то молекули повітря земної атмосфери розсіялися по всьому Всесвіту. Але якщо молекули повітря земної атмосфери не перебували б у тепловому русі, то всі вони “впали” б на Землю. Тяжіння i тепловий рух приводять до стаціонарного стану газу, при якому його тиск i концентрація зменшується з висотою.
Тиск ідеального газу, що знаходиться в однорідному полі тяжіння за умови сталості температури газу змінюється з висотою за експоненціальним законом, який називають барометричною формулою (П. Лаплас, 1821 р.):
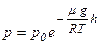 .
.
Із цієї формули можна зробити висновок, що тиск газу зменшується із висотою експоненціально і тим швидше, чим важчий газ (чим більше 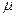 ) і чим нижча температура (див. рис.).
) і чим нижча температура (див. рис.).
Барометрична формула дозволяє знайти співвідношення між концентраціями газу на різній висоті.
Використаємо рівняння стану ідеального газу у вигляді 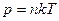 , де
, де 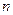 – концентрація молекул газу. При
– концентрація молекул газу. При 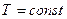 отримуємо
отримуємо
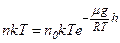 ,
,
де 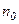 – концепція молекул на висоті
– концепція молекул на висоті 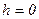 , а скільки
, а скільки 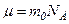 , а
, а 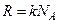 , то
, то
 .
.
Якщо молекули, що перебувають у стані хаотичного теплового руху, знаходяться у зовнішньому потенціальному полі (наприклад, у полі тяжіння Землі), то розподіл молекул описується законом Больцмана:
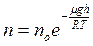 або
або 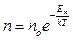 – розподіл Больцмана,
– розподіл Больцмана,
де 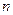 – концентрація молекул на висоті
– концентрація молекул на висоті 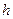 (
(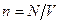 ),
),
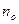 – концентрація молекул на висоті
– концентрація молекул на висоті 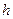 =0 м,
=0 м,
μ – молярна маса газу,
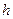 – висота над поверхнею землі,
– висота над поверхнею землі,
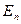 – потенціальна енергія молекули (наприклад, у полі тяжіння Землі).
– потенціальна енергія молекули (наприклад, у полі тяжіння Землі).
Із закону Больцмана випливає, що у полі тяжіння Землі:
1) із збільшенням висоти концентрація молекул газу зменшується за експоненціальним законом,
2) при високих температурах концентрація молекул n незначно зменшується з висотою і при 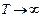
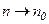 , тобто підвищення температури викликає вирівнювання концентрації газу за висотою,
, тобто підвищення температури викликає вирівнювання концентрації газу за висотою,
3) при 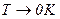
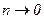 , тобто всі молекули під дією сили тяжіння опускаються на дно посудини.
, тобто всі молекули під дією сили тяжіння опускаються на дно посудини.
3. *Зіткнення молекул, середня довжина вільного пробігу молекул.
Молекули газу, перебуваючи у стані хаотичного теплового руху, безперервно стикаються одна з одною.
Зіткненням молекул називають процес взаємодії між молекулами, внаслідок якого молекули змінюють напрямок свого руху.
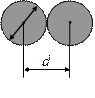
Мінімальна відстань, на яку зближуються при зіткненні центри двох молекул, називають ефективним діаметром d молекули (див. рис.).
Ефективний діаметр молекул залежить від:
· енергії молекул, а отже, і від температури (підвищенням температури ефективний діаметр молекул зменшується),
· хімічної природи газу.
Середнє число зіткнень молекули за одиницю часу 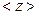 становить:
становить:
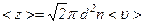 ,
,
де 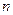 – концентрація молекул,
– концентрація молекул,
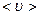 – середня арифметична швидкість руху молекул.
– середня арифметична швидкість руху молекул.
Між двома послідовними зіткненнями молекули рухаються рівномірно і прямолінійно.
 Довжиною вільного пробігу молекули називають відстань
Довжиною вільного пробігу молекули називають відстань 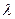 , яку молекула пролітає між двома послідовними зіткненнями.
, яку молекула пролітає між двома послідовними зіткненнями.
Ці відстані можуть бути різними. Тому в кінетичній теорії вводять поняття середньої довжини вільного пробігу молекул 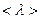 :
:
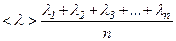 ,
,
де 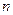 – кількість зіткнень.
– кількість зіткнень.
Середня довжина вільного пробігумолекул визначається середнім шляхом, що проходить молекула за одиницю часу, тому чисельно дорівнює середній арифметичній швидкості 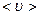 і якщо за одиницю часу молекула стикається з іншими молекулами
і якщо за одиницю часу молекула стикається з іншими молекулами 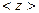 разів, то
разів, то
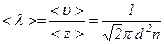 .
.
Оскільки 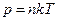 , то
, то 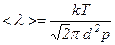 .
.
Середня довжина вільного пробігу є характеристикою всієї сукупності молекул газу при даних значеннях тиску p і температури T.
При сталій температурі середня довжина вільного пробігу є обернено пропорційною до тиску, тобто
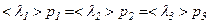 .
.
Приведемо значення довжини вільного пробігу 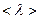 молекул повітря при 0°С і різних тисках:
молекул повітря при 0°С і різних тисках:
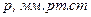 | 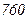 | 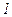 | 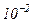 | 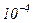 |
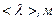 | 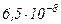 | 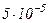 | 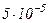 | 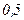 |
4. *Поведінка газів за умов низького тиску.
Якщо з посудини відкачати газ, то із зниженням тиску кількість зіткнень взаємних зіткнень зменшується, що призводить до збільшення довжини їх вільного пробігу. При достатньо великому розрідженні зіткнення між молекулами досить рідкі, тому в основному відбуваються зіткнення молекул із стінками посудини. Вакуумом називають стан газу, при якому середня довжина вільного пробігу молекул 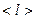 порівняна або більша характерного розміру посудини
порівняна або більша характерного розміру посудини 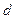 , у якій газ знаходиться.
, у якій газ знаходиться.
В залежності від співвідношення 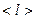 і
і 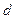 розрізняють:
розрізняють:
· низький вакуум (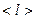 <<
<< 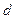 ),
),
· середній вакуум (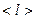 ≤
≤ 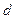 ),
),
· високий вакуум (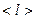 >
> 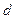 ) – ультрарозріджений газ,
) – ультрарозріджений газ,
· надвисокий вакуум ( >>
>> ).
).
Остановимся на некоторых свойствах ультраразреженных газов. Так как в состоянии ультраразрежения молекулы практически друг с другом не сталкиваются, то газ в этом состоянии не обладает внутренним трением. Отсутствие соударений между молекулами разреженного газа отражается также на механизме теплопроводности. Если при обычных давлениях перенос энергии молекулами производится «эстафетой», то при ультраразрежении каждая молекула сама должна перенести энергию от одной стенки сосуда к другой. Явление уменьшения теплопроводности вакуума при понижении давления используется на практике для создания тепловой изоляции. Например, для уменьшения теплообмена между телом и окружающей средой тело помещают в сосуд Дьюара*, имеющий двойные стенки, между которыми находится разреженный воздух, теплопроводность которого очень мала.
5. *Вакуумна техніка.
Створення вакууму має велике практичне значення, оскільки у багатьох сучасних електронних пристроях використовуються електронні пучки, формування яких можливе лише в умовах вакууму. Для отримання різного ступеня розрідження застосовують вакуумні насоси., що дозволяють отримати попереднє розрідження (форвакуум) приблизно до 0,13 Па, а також вакуумні насоси і лабораторні пристрої, що дозволяють отримати тиски до 13,3 мкПа — 1,33 пПа (10–7 ÷ 10–14 мм рт. ст.).
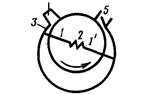 Принцип работы форвакуумного насоса представлен на рис. 72. Внутри цилиндрической полости корпуса вращается эксцентрично насаженный цилиндр. Две лопасти 1 и 1', вставленные в разрез цилиндра и раздвигаемые пружиной 2, разделяют пространство между цилиндром и стенкой полости на две части. Газ из откачиваемого сосуда поступает в область 3, по мере поворачивания цилиндра лопасть 1 отходит, пространство 3 увеличивается и газ засасывается через трубку 4. При дальнейшем вращении лопасть 1' отключает пространство 3 от трубки 4 и начинает вытеснять газ через клапан 5 наружу. Весь процесс непрерывно повторяется.
Принцип работы форвакуумного насоса представлен на рис. 72. Внутри цилиндрической полости корпуса вращается эксцентрично насаженный цилиндр. Две лопасти 1 и 1', вставленные в разрез цилиндра и раздвигаемые пружиной 2, разделяют пространство между цилиндром и стенкой полости на две части. Газ из откачиваемого сосуда поступает в область 3, по мере поворачивания цилиндра лопасть 1 отходит, пространство 3 увеличивается и газ засасывается через трубку 4. При дальнейшем вращении лопасть 1' отключает пространство 3 от трубки 4 и начинает вытеснять газ через клапан 5 наружу. Весь процесс непрерывно повторяется.
Для получения высокого вакуума применяются диффузионные насосы (рабочее вещество — ртуть или масло), которые не способны откачивать газ из сосудов начиная с атмосферного давления, но способны создавать добавочную разность давлений, поэтому их употребляют вместе с форвакуумными насосами. Рассмотрим схему действия диффузионного насоса (рис. 73). В колбе ртуть нагревается, пары ртути, поднимаясь по трубке 1, вырываются из сопла 2 с большой скоростью, увлекая за собой молекулы газа из откачиваемого сосуда (в нем создан предварительный вакуум). Эти пары, попадая затем в «водяную рубашку», конденсируются и стекают обратно в резервуар, а захваченный газ выходит в пространство (через трубку 3), в котором уже создан форвакуум. Если применять многоступенчатые насосы (несколько сопл расположены последовательно), то реально при хороших уплотнениях можно с помощью них получить разрежение до 10–7 мм рт. ст.
Для дальнейшего понижения давления применяются так называемые «ловушки». Между диффузионным насосом и откачиваемым объектом располагают специально изогнутое колено (1 или 2) соединительной трубки (ловушку), которую охлаждают жидким азотом (рис. 74). При такой температуре пары ртути (масла) вымораживаются и давление в откачиваемом сосуде понижается приблизительно на 1—2 порядка. Описанные ловушки называют охлаждаемыми; можно применять также неохлаждаемые ловушки. Специальное рабочее вещество (например, алюмогель) помещают в один из отростков соединительной трубка вблизи откачиваемого объекта, которое поддерживается при температуре 300°С. При достижении высокого вакуума алюмогель охлаждается до комнатной температуры, при которой он начинает поглощать имеющиеся в системе пары. Преимущество этих ловушек состоит в том, что с их помощью в откачиваемых объектах можно поддерживать высокий вакуум уже после непосредственной откачки в течение даже нескольких суток.
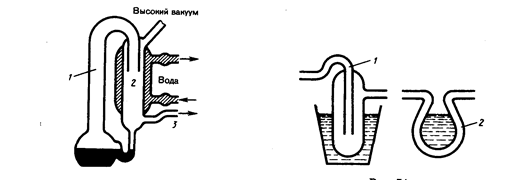 Рассмотрим два сосуда 1 и 2, поддерживаемых соответственно при температурах T1 и Т2 (рис. 75) и соединенных между собой трубкой. Если длина свободного пробега молекул гораздо меньше диаметра соединительной трубки (<l> << d), то стационарное состояние газа характеризуется равенством давлений в обоих сосудах (p1 = р2). Стационарное же состояние ультраразреженного газа (<l> >> d), находящегося в двух сосудах, соединенных трубкой, возможно лишь в том случае, когда встречные потоки частиц, перемещающихся из одного сосуда в другой, одинаковы, т. е.
Рассмотрим два сосуда 1 и 2, поддерживаемых соответственно при температурах T1 и Т2 (рис. 75) и соединенных между собой трубкой. Если длина свободного пробега молекул гораздо меньше диаметра соединительной трубки (<l> << d), то стационарное состояние газа характеризуется равенством давлений в обоих сосудах (p1 = р2). Стационарное же состояние ультраразреженного газа (<l> >> d), находящегося в двух сосудах, соединенных трубкой, возможно лишь в том случае, когда встречные потоки частиц, перемещающихся из одного сосуда в другой, одинаковы, т. е.

где п1 и п2 — концентрации молекул в обоих сосудах, <v1> и <v2> — средние скорости молекул. Учитывая, что n = p/(kT) и 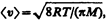 из условия (49.1) получаем
из условия (49.1) получаем
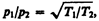
т. е. в условиях высокого вакуума выравнивания давлении не происходит. Если в откачанный стеклянный баллон (рве. 76) на пружину 1 насадить слюдяной листочек 2, одна сторона которого зачернена, и освещать его, то возникнет разность температур между светлой и зачерненной поверхностями листочка. Из выражения (49.2) следует, что в данном случае разным будет и давление, т. е. молекулы от зачерненной поверхности будут отталкиваться с большей силой, чем от светлой, в результате чего листочек отклонится. Это явление называется радиометрическим эффектом. На радиометрическом эффекте основано действие радиометрического манометра.
Лекція 3. Основи термодинаміки.
 2014-02-03
2014-02-03 3990
3990