Классификация спектров
В зависимости от типа взаимодействия излучения с веществом различают спектры испускания и спектры поглощения.
Спектры испускания обусловлены переходами, при которых Ei > Ej. Виды спектров испускания:
§ эмиссионные спектры – испускаются термически возбуждёнными частицами;
§ спектры люминесценции – испускаются нетермически возбуждёнными частицами (под действием энергии электромагнитного излучения, электрического поля, энергии химической реакции и др.).
Спектры поглощения (абсорбционные спектры) обусловлены переходами, при которых Ei < Ej.
В зависимости от природы частиц спектры делят на атомные (линейчатые) и молекулярные (полосатые). В свою очередь, молекулярные спектры могут быть:
§ вращательными;
§ колебательными;
§ электронными.
Для целей анализа наиболее часто используют атомные эмиссионные и молекулярные абсорбционные спектры, поэтому в последующих разделах будут подробно рассмотрены вопросы их получения, регистрации и использования для качественного и количественного анализа.
2.2. Атомные эмиссионные спектры.
Эмиссионная фотометрия пламени
Атомные эмиссионные спектры состоят из отдельных линий, поэтому их называют «линейчатыми» (рис.33).
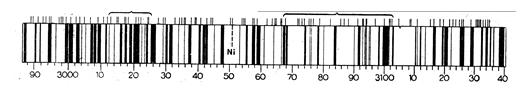
Рис. 33. Атомный эмиссионный спектр
Для каждого элемента характерен свой вид спектра. Спектры атома и иона различаются, т. к. у них разное электронное строение.
Атомные эмиссионные спектры обусловлены только спонтанными (самопроизвольными) электронными переходами в термически возбуждённых атомах. Если атомной системе сообщить энергию, то электроны атомов переходят в возбуждённое состояние. Через 10–8 с они спонтанно возвращаются в основное состояние (рис. 34).
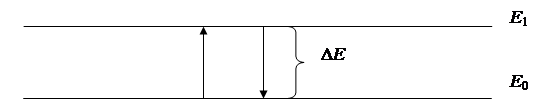
Рис. 34. Происхождение эмиссионных спектров.
При этом избыточная энергия испускается в виде квантов света с частотой ν = Δ Е / h.
Основные характеристики линий эмиссионного спектра:
1. Длина волны (λ) – используются для качественного анализа, зависит от энергии перехода:
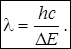
2. Интенсивность линии (I) – используются для количественного анализа, зависит от энергии перехода, числа частиц и вероятности перехода:
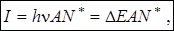
где А – вероятность спонтанного перехода;
N* – концентрация возбуждённых частиц.
Наибольшей интенсивностью отличаются резонансные линии, поскольку вероятность спонтанного перехода Е 1 ® Е 0 наиболее высока. Поэтому в аналитической химии чаще всего используют эти линии. Кроме того, они наиболее чувствительны, что позволяет химику-аналитику вести анализ в области малых концентраций.
 2014-02-13
2014-02-13 3768
3768







