Синтез белка – сложный, многостадийный процесс, зависящий от функционального состояния ДНК, РНК и непосредственно белок-синтезирующей системы. Поэтому механизмы регуляции скорости образования белка реализуются как в ядре, так и в цитоплазме. Из рассмотренного понятно, что в образовании полипептидной цепи участвуют все три типа РНК. Таким образом, транскрипция является одним из факторов, определяющих скорость белкового синтеза. Экспрессия генов увеличивает скорость транскрипции, репрессия - снижает. Первоначально рассмотрим, как это реализуется на примере прокариот.
Регуляция синтеза белка у прокариот. В 1961 г. французские исследователи Ф. Жакоб и Ж. Моно впервые провели фундаментальные исследования индукции генов, кодирующих β-галактозидазу и связанные с ней ферменты в клетках кишечной палочки E.сoli. Эти исследования помогли им сформулировать гипотезу об опероне и регуляции синтеза белка в клетках прокариот.
Опероном называется совокупность генов, способных включаться и выключаться в зависимости от метаболических потребностей клетки.
Авторами впервые были оценены регуляторные механизмы на примере лактозного или Lac-оперона, строение которого представлено на рис.27.
На участке ДНК, соответствующем оперону, находятся три структурных гена (z, y, α). Эти гены кодируют β-галактозидазу, гидролизирующую лактозу до глюкозы и галактозы, г алактозидпермеазу, переносящую лактозу через клеточную мембрану, а также галактозидтрансацетилазу (белок А), переносящую ацетильный остаток с ацетил–КоА на галактозу. Кроме структурных генов, оперон содержит регуляторные последовательности: ген-оператор (о), примыкающий к 3′-последовательности структурного гена, и ген-регулятор, кодирующий белок-репрессор. К гену-оператору примыкает промотор(р) - начальный сайт инициации транскрипции. Белок-репрессор, взаимодействуя с геном-оператором, частично блокирует область промотора. Это препятствует присоединению РНК-полимеразы к промотору, и транскрипция отменяется. При росте Е.coli на среде с глюкозой лактозный оперон выключен. Его функционирование и регуляция имеют место при выращивании клеток на лактозной среде. Даже в отсутствие галактозидилпермеазы определенное число молекул лактозы поступает в клетку и вступает во взаимодействие с белком-репрессором, находящимся не только в свободном состоянии, но и ассоциированным с геном-оператором (лактоза - индуктор). В результате происходит деблокирование промотора и транскрипция становится возможной. Образование β-галактозидазы приводит к гидролизу лактозы и появлению в клетке глюкозы, источника энергии. В результате интенсификации транскрипции и синтеза β-галактозидазы уменьшается количество индуктора (лактозы) и функционирование Lac-оперона репрессируется. Таким образом, реализуется регуляция по принципу обратной связи. Центральную роль здесь играет белок – репрессор. Он состоит из четырех субъединиц и имеет два центра связывания: с индуктором - лактозой и геном-оператором. Попеременно (но не одновременно) связываясь с индуктором или с геном-оператором, он включает индукцию или репрессию Lac-оперона.
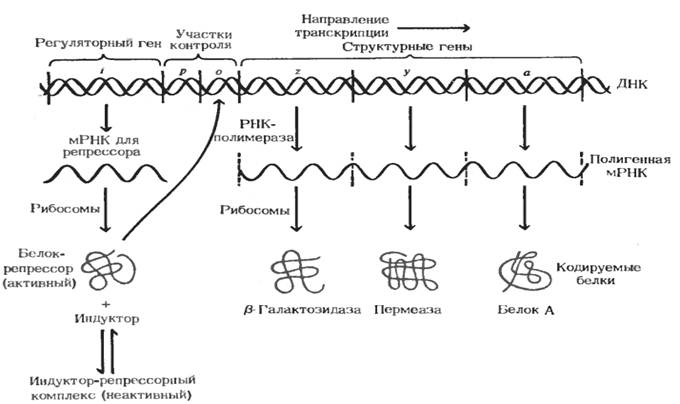
Рис. 27 Схематическое изображение Lac-оперона
Имеется еще один механизм регуляции функционирования оперона. Если бактерии культивировать на среде с глюкозой, то лактозный оперон не функционирует. Это обусловлено тем, что какой-то продукт расщепления глюкозы (катаболит) репрессирует данный процесс. Каков же механизм этой репрессии? Оказалось, что РНК-полимераза присоединяется к промотору при помощи специального белка САР (catabolite gene activation protein), комплекс которого с цАМФ активирует катаболитные гены. Катаболит глюкозы ингибирует фермент аденилатциклазу, катализирующую образование цАМФ, комплекс не образуется, и индукции лактозного оперона не происходит. Таким образом, скорость транскрипции определяется образованием комплексов САР-цАМФ и их связыванием с промотором.
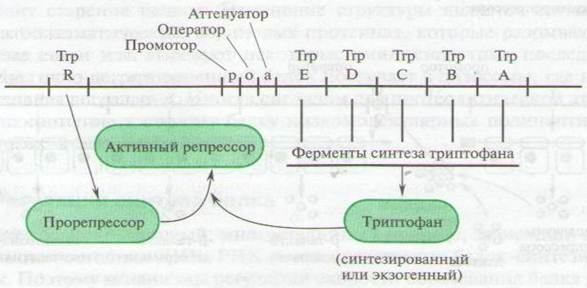
Рис. 28 Строение триптофанового оперона
В случае лактозного оперона лактоза - субстрат для β-галактозидазы - индуцирует синтез фермента за счет инактивации белка-репрессора и восстановления функционирования оперона. Иное явление наблюдается в процессе регуляции синтеза ферментов, осуществляющих образование аминокислоты триптофана в той же клетке Е. сoli.
Механизм регуляции транскрипции заключается в следующем. Белок – репрессор синтезируется в неактивном состоянии в виде прорепрессора. Конечный продукт деятельности ферментов – триптофан - является активатором белка-репрессора, который после активации взаимодействует с геном-оператором и останавливает транскрипцию (рис. 28).
Имеется еще один механизм регуляции, связанный со снижением скорости транскрипции, так называемая аттенуация. В клетках Е.сoli., как и вдругих бактериях, между первым структурным геном и геном-оператором расположена лидерная последовательность порядка 140-150 нуклеотидов, так называемый аттенуатор. Даже небольшой избыток конечного продукта того же триптофана приводит к тому, что РНК-полимераза, достигнув аттенуатора, перестает транскрибировать оперон. Уменьшение конечного продукта вновь включает транскрипцию.
Что касается трансляции, то у прокариот она играет значительно меньшую роль в регуляторных процессах, чем транскрипция.
Регуляция синтеза белка у эукариот. Это более сложный процесс, так как транскрипция и трансляция происходят в разных компартментах и обеспечиваются большим количеством соответствующих структур.
На уровне транскрипции регуляторные механизмы у прокариот и эукариот имеют ряд общих черт. Рассмотрим некоторые отличительные особенности. Для клеток эукариот характерна амплификация генов и их перестройка. Оба механизма обеспечивают резкое увеличение копий тех или иных белков, необходимых для реализации клеточного метаболизма.
Известно, что в клетках эукариот ДНК, соединенная с белками (гистонами), упакована в нуклеосомы. В этом состоянии транскрипция невозможна, и для экспрессии генов необходимо деблокирование транскриптона. Следовательно, образование и разрушение нуклеосом является важным фактором регуляции эукариотических генов. Каким же образом происходит деблокирование транскриптона?
Фосфорилирование гистонов. В результате действия белков гормонов происходит опосредованное фосфорилирование ядерных белков – гистонов и разрушение нуклеосом. Матрица при этом становится доступной для основных факторов инициации транскрипции, и начинается синтез РНК. При прекращении действия гормонов нуклеосомы восстанавливаются.
Ацетилирование и деацетилирование гистонов. Это важный фактор регуляции генной активности. Оказалось, что фермент гистон- ацетилаза ассоциирована с фактором ТАФ. Ацетилирование проходит по терминальному остатку лизина в полипептидной цепи гистона. В результате ацетилирования положительный заряд белка уменьшается и сродство гистона к отрицательно заряженной ДНК снижается. Это может привести к разрушению нуклеосом и деблокированию транскриптона. Деацетилирование гистонов приводит к противоположному эффекту. Специфические ацетилаза и деацетилаза ассоциированы с белками инициации транскрипции.
Регуляторными элементами являются белки инициаторного комплекса, описанные ранее, и особые нуклеотидные последовательности, способствующие интенсификации транскрипции – энхансеры. Характерная особенность этих структур заключается в том, что они влияют на скорость транскрипции независимо от локализации в опероне. Белки, взаимодействующие с энхансерами, называются энхансерными элементами, расположенными на расстоянии 1000-2000 пар оснований от региона промотора. Эти белковые факторы способны воздействовать на инициацию транскрипции благодаря образованию ДНК-петли, что приводит к пространственному сближению энхансерных элементов и, например, белков ТАТА.
Весьма существенным фактором регуляции транскрипции является процессинг РНК. Образование зрелых мРНК зависит от скоростей кэпирования, образования полиА, а также скорости сплайсинга. Для полицистронных мРНК определенное регуляторное значение имеет альтернативный сплайсинг.
Кроме белков инициаторного комплекса, на скорость транскрипции оказывают существенное влияние ДНК-связывающие белки. Из нескольких семейств наиболее известны белки типа: цинковые пальцы, спираль-виток-спираль и гомеодоменные белки. Специфическое связывание этих белков с ДНК происходит в результате взаимодействия боковых радикалов аминокислотных остатков белка с основаниями ДНК.
Цинковые пальцы представляют собой серию повторяющихся доменов (от 2 - до 9), имеющих форму пальца. В центре координации каждого домена находится цинк. В одних случаях цинк соединен с четырьмя остатками цистеина, в других – с двумя цистеинами и двумя гистидинами.
На синтез белка также влияет скорость транспорта РНК в цитоплазму. В цитоплазме мРНК, взаимодействуя с определенными белками, образует информосому – своеобразное депо, из которого мРНК освобождается по мере надобности для синтеза белка. Скорость освобождения мРНК также является фактором регуляции белкового синтеза.
Скорость синтеза белка напрямую зависит от количества мРНК, которое определяется временем ее «полужизни» или стабильностью in vivo. Таким образом, факторы, влияющие на стабильность мРНК, являются регуляторами экспрессии генов и, как следствие, белкового синтеза. Одной из структур, определяющих стабильность мРНК, является полиА – последовательность на 3'-ОН-конце. Факторы, регулирующие экспрессию генов и синтез белка, представлены в таблице 5.
Таблица 5 Факторы, влияющие на регуляцию транскрипции эукариот
| № п/п | Факторы |
| Амплификация генов | |
| Перегруппировка генов | |
| Белки инициаторного комплекса | |
| ДНК-связывающие белки | |
| Сплайсинг мРНК | |
| Стабильность мРНК | |
| Транспорт мРНК в цитоплазму |
Лимитирующей стадией процесса трансляции является ее инициация. Наиболее изучен процесс изменения скорости инициации трансляции в результате фосфорилирования фактора инициации IF2. Реакция катализируется ферментом, IF2 –киназой, причем присоединение фосфатной группы инактивирует фактор инициации. Этот феномен был изучен на примере синтеза гемоглобина в ретикулоцитах. Сначала было установлено, что глобин синтезируется только в присутствии гема. Затем была выстроена вся система регуляции синтеза глобина. Оказалось, что активация IF2 – киназы происходит за счет ее фосфорилирования цАМФ-зависимой протеинкиназой. Взаимодействие этой протеинкиназы с цАМФ и ее активацию блокирует гем, выполняя тем самым негативный контроль синтеза гемоглобина.
Регуляция синтеза белка осуществляется также на стадии процессинга белка. Модификации новосинтезированных полипептидов осуществляются при помощи соответствующих ферментов, активность которых, в свою очередь, находится под генетическим контролем. К этим модификациям относятся: метилирование, фосфорилирование, гликозилирование, а также ограниченный протеолиз.
 2014-02-17
2014-02-17 2246
2246