Обратимые ингибиторы могут быть конкурентными и неконкурентными
Различия между этими типами обратимых ингибиторов касаются их взаимоотношений с субстратом. Если ингибитор конкурирует с субстратом за место связывания на ферменте и действие одного может быть отменено избытком другого, говорят о конкурентном торможении, в противном случае речь идет о неконкурентных ингибиторах.
Различают два механизма конкурентного торможения.
А.Конкурентное торможение путем связывания активного центра. Классический конкурентный ингибитор - вещество, которое имеет структурное сходство с субстратом фермента. Благодаря этому подобию ингибитор может связываться с активным центром вместо субстрата. Это своеобразная молекулярная ошибка. Однако, поскольку субстрат и ингибитор не идентичны полностью, фермент не способен катализировать превращение ингибитора в продукт. Ингибитор просто блокирует активный центр фермента. Если субстрат свяжется с активным центром раньше, чем ингибитор, ингибитор не может связаться с ферментом. Нельзя одновременно обоим связаться с активным центром. Такой способ конкурентного торможения получил название изостерического из-за схожести (изос) структур субстрата и ингибитора. Наиболее часто в клетке в роли классического конкурентного ингибитора выступает продукт данной реакции, что имеет глубокий практический смысл.
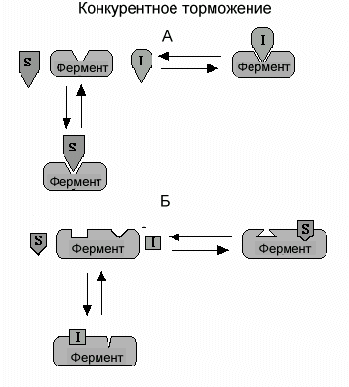 Б. Конкурентное торможение путем изменения конформации фермента. В отличие от классического варианта, ингибитор связывается не с активным центром, а со специальным центром, связывающим ингибитор, который расположен вдали от активного центра. Связывание ингибитора вызывает изменение пространственной структуры (изменение конформации) в области активного центра, которое не позволяет присоединиться субстрату. Предшествующее связывание субстрата к активному центру в свою очередь, вызывает изменения конформации центра связывания ингибитора, которое предотвращает связывание ингибитора. И субстрат и ингибитор не могут одновременно связаться с ферментом. В этом виде конкурентного торможения ингибитор может иметь любую химическую структуру, поскольку они связываются с различными участками фермента.
Б. Конкурентное торможение путем изменения конформации фермента. В отличие от классического варианта, ингибитор связывается не с активным центром, а со специальным центром, связывающим ингибитор, который расположен вдали от активного центра. Связывание ингибитора вызывает изменение пространственной структуры (изменение конформации) в области активного центра, которое не позволяет присоединиться субстрату. Предшествующее связывание субстрата к активному центру в свою очередь, вызывает изменения конформации центра связывания ингибитора, которое предотвращает связывание ингибитора. И субстрат и ингибитор не могут одновременно связаться с ферментом. В этом виде конкурентного торможения ингибитор может иметь любую химическую структуру, поскольку они связываются с различными участками фермента.
 2014-02-17
2014-02-17 624
624








