Схема 1. Механизм ишемического гипоксического повреждения клеток
2. Повреждение клетки, вызванное свободными радикалами кислорода. Чаще всего такое повреждение возникает под воздействием химических веществ, лучистой энергии, кислорода и других газов, а также при старении клеток, разрушении опухолей макрофагами и в некоторых иных случаях.
Свободные радикалы представляют собой молекулы кислорода, имеющие один непарный электрон на внешней орбите. В таком состоянии радикал исключительно активен и нестабилен и вступает в реакции с неорганическими и органическими соединениями — белками, липидами и углеводами.
Для повреждения клетки наибольшее значение имеют три реакции, в которые вступают свободные радикалы.
• Свободнорадикальное пероксидное окисление липидов (СПОЛ) мембран. Свободные радикалы в присутствии кислорода могут вызывать пероксидное окисление липидов плазматической мембраны и органелл. Липидно-радикальные взаимодействия приводят к образованию пероксидов, которые сами по себе являются активными соединениями, инициирующими последующее повреждение других жирных кислот; возникает цепь аутока-талитических реакций, обусловливающая обширное повреждение мембран, органелл и самих клеток.
• Окислительное превращение белков. Свободные радикалы вызывают перекрестное связывание таких лабильных аминокислот, как метионин, гистидин, цистин и лизин, а также фрагментацию полипептидных цепей. Окислительное превращение усиливает разрушение ключевых ферментов посредством нейтральных протеаз, содержащихся в цитозоле.
• Повреждение ДНК. Свободные радикалы вступают в реакцию с тимином, входящим в состав ДНК, Такое повреждение ДНК ведет к гибели клетки или ее злокачественному превращению. Митохондриальная ДНК также повреждается.
Свободные радикалы могут разрушаться спонтанно. Например, супероксидный анион-радикал является нестабильным соединением и спонтанно разрушается с образованием кислорода и пероксида водорода. Однако имеется несколько ферментных и неферментных систем, которые способствуют окончанию или инактивации свободнорадикальных реакций. Эндогенными или экзогенными антиоксидантами являются витамин Е; сульфгид-рилсодержащие соединения — цистеин и глютатион; белки сыворотки — альбумин, церулоплазмин и трансферрин. Полагают, что трансферрин действует как антиоксидант, связывая свободное железо, которое, как известно, может играть роль катализатора образования свободных радикалов.
Среди ферментов выделяют супероксиддисмутазу, способную превращать супероксидный анион-радикал в пероксид водорода.
Каталаза, сосредоточенная в пероксисомах, разрушает пероксид водорода до кислорода и воды.
При многих патологических процессах конечный результат действия свободных радикалов зависит от баланса между образованием свободных радикалов и их разрушением.
3. Токсическое повреждение. Примером такого повреждения является действие химических веществ, вызывающих повреждение клетки посредством одного из двух механизмов. Во-первых, часть водорастворимых соединений может действовать непосредственно, связываясь с некоторыми молекулами или органел-лами. Например, при попадании в организм хлорида ртути ртуть связывает сульфгидрильные группы клеточной мембраны и других белков, вызывая повышение проницаемости клеточной мембраны и торможение АТФаза-зависимого транспорта. В подобных случаях наиболее выраженные изменения наблюдаются в клетках, которые используют, абсорбируют, выделяют или концентрируют эти химические соединения. При попадании в организм хлорида ртути в наибольшей степени страдают клетки желудочно-кишечного тракта и почек. Цианид непосредственно воздействует на ферменты митохондрий. Многие противоопухолевые химиотерапевтические препараты, в том числе антибиотики, также вызывают повреждение клеток посредством цитоток-сического действия.
Во-вторых, некоторые другие химические соединения, особенно жирорастворимые токсины, биологически неактивны и вначале превращаются в токсичные метаболиты, которые затем действуют на клетки-мишени. Хотя эти метаболиты могут вызывать повреждение мембран и клеток путем прямого ковалентно-го связывания с мембранными белками и липидами, наиболее важный механизм повреждения мембран включает образование реактивных свободных радикалов и последующее СПОЛ.
В классической морфологии нелетальное повреждение клеток называется дистрофией (см. лекции 4—7). В большинстве случаев она относится к обратимым повреждениям.
Некроз наряду с апоптозом является одним из двух морфологических выражений смерти клетки (см. лекцию 8).
Апоптоз ответствен за многочисленные физиологические и патологические процессы, происходящие в организме.
1. В результате апоптоза происходят запрограммированное разрушение клеток в процессе эмбриогенеза (включая имплантацию, органогенез и инволюцию) и метаморфоз.
2. Посредством апоптоза развивается гормонозависимая инволюция тканей у взрослых, например атрезия фолликулов в яичниках во время менопаузы, регрессия лактирующей молочной железы после прекращения кормления ребенка.
3. Происходит уничтожение клеток в пролиферирующих клеточных популяциях, таких как эпителий крипт тонкой кишки.
4. Наступает смерть клеток в опухолях, как подвергающихся регрессии, так и с активным ростом клеток.
5. Это механизм смерти иммунных клеток — как В-, так и Т-лимфоцитов, после истощения цитокинов, а также уничтожения аутореактивных Т-клеток в развивающейся вилочковой железе.
6. Это механизм патологической атрофии гормонозависимых тканей, например атрофия предстательной железы после кастрации и исчезновение лимфоцитов в вилочковой железе после введения глюкопротеидов.
7. Это патологическая атрофия паренхиматозных органов после перекрытия протока, например, поджелудочной железы, околоушной слюнной железы, мочеточника.
8. Смерть клетки, вызванная цитотоксическими Т-клетками, например отторжение трансплантата.
9. Это гибель клеток при некоторых вирусных заболеваниях, например при вирусном гепатите (фрагменты клеток при апопто-зе известны как тельца Каунсильмена).
10. Клеточная смерть, вызванная различными слабыми повреждающими воздействиями, которые в больших дозах приводят к гибели клетки (радиация, высокие или низкие температуры, ци-тотоксические противоопухолевые препараты и, возможно, гипоксия), также представляет собой апоптоз.
Механизмы апоптоза. Апоптоз начинается скорее всего в результате действия гормонов и других трофических факторов и является регулятором плотности клеточной популяции. Кроме того, апоптоз может быть одним из механизмов удаления аномальных клеток или клеток, поврежденных токсинами, радиацией и другими воздействиями.
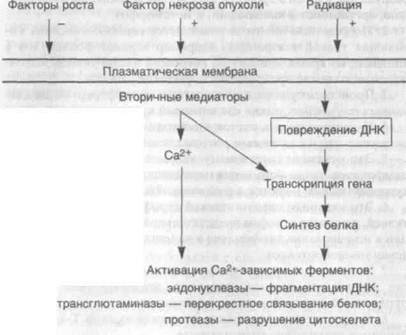
Механизмы возникновения апоптоза различны и зависят от характера воздействия и типа клеток, однако последовательность событий, которые приводят к конечному результату, до конца не выяснена. Вместе с тем ряд механизмов уже установлен (схема 2).
|
| Схема 2. Механизмы апоптоза |
1. Конденсация хроматина. Она обусловлена расщеплением ядерной ДНК в участках связей между нуклеосомами и приводит к образованию фрагментов. Такие фрагменты создают характерную для апоптоза картину ядра, отличную от таковой при некрозе, когда ядро выглядит пятнистым. Эта интернуклеосомальная фрагментация ДНК развивается с участием кальцийчувствитель-ной эндонуклеазы. Эндонуклеаза постоянно присутствует в клетках некоторых типов, например тимоцитах, где она активируется под влиянием цитозольного кальция, тогда как в других клетках фермент образуется перед началом апоптоза.
2. Нарушения объема и формы клеток. Эти процессы связывают с активностью трансглютаминазы, которая вызывает перекрестное связывание цитоплазматических белков, образующих оболочку под плазматической мембраной.
3. Фагоцитоз апоптозных телец макрофагами и клетками других типов. Обеспечивается рецепторами этих клеток, которые связывают и поглощают апоптозные клетки. Одним из таких рецепторов на макрофаге является витронектиновый рецептор
дельта3-
интегрин, который обеспечивает фагоцитоз апоптозных нейтро-филов.
4. Зависимость апоптоза в большинстве случаев от активации гена и синтеза белка является одной из важных его особенностей. При этом индукция генов обеспечивается за счет "стимулов", вызывающих апоптоз, таких как стрессорные белки и протоонкоге-ны. Однако эти гены не связаны напрямую с началом апоптоза. Выявлены апоптозспецифические гены, которые стимулируют или тормозят смерть клетки.
5. Некоторые гены, участвующие в возникновении и росте злокачественной опухоли (онкогены и супрессорные гены), играют регуляторную роль в индукции апоптоза. Например, онкоген р53 в норме стимулирует апоптоз; р53 необходим для развития апоптоза после повреждения ДНК радиацией, хотя апоптоз, вызванный глюкокортикоидами или старением, не зависит от р53. ■ Таким образом, апоптоз является разновидностью смерти клетки, для которой характерна конденсация и фрагментация ДНК. Апоптоз обеспечивает уничтожение клеток при нормальном развитии, тканевом росте, органогенезе и в органах иммунной системы.
Апоптоз может быть также индуцирован под воздействием патологических стимулов. Некоторые из уже известных эффек-торных механизмов включают активацию эндонуклеазы, вызванную содержащимся в цитозоле кальцием и приводящую к фрагментации ДНК. Активация трансглютаминазы частично влияет на изменение формы и размеров клеток. Апоптоз заканчивается рецепторнозависимым фагоцитозом апоптозных телец. В некоторых случаях в индукции апоптоза участвуют транскрипция генов и синтез белка, а процесс апоптоза регулируется группой генов, которые участвуют в нормальном росте и дифферен-цировке клеток.
 2014-02-18
2014-02-18 630
630






