Свойства простых веществ.

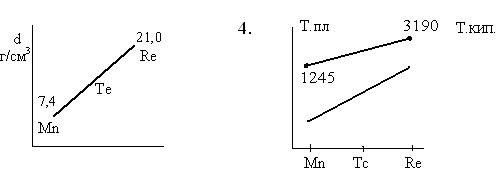
3. Энергия кристаллической решетки, плотность, температуры плавления и кипения растут от Mn к Re
3.1. Ряд напряжений
Mg, Mn, Zn …. H …. Cu, Tc, Re
Mn + 2H+ = Mn2+ + H2 (Tc и Re нет).
3.2.Диаграмма Фроста для элементов седьмой группы
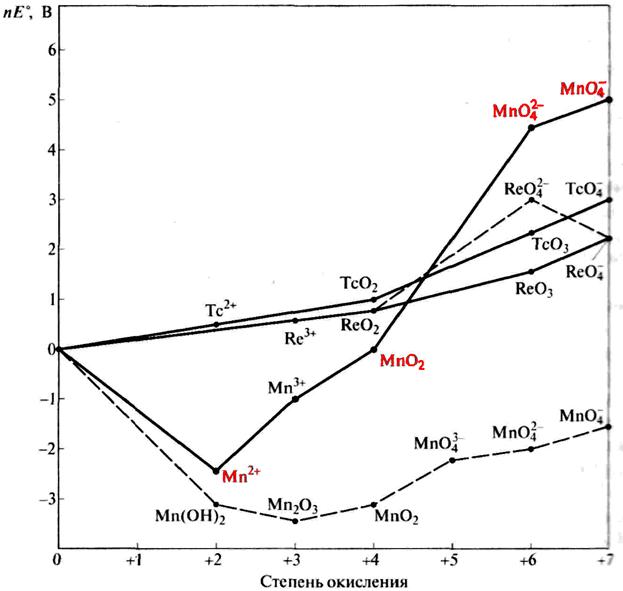
Рис.1. Диаграмма Фроста для элементов седьмой группы при рН =0 (сплошные линии) и рН =14 (пунктирные линии)
Выводы:
а) Наиболее устойчивы соединения Mn (II)
б) Mn – 2 e = Mn2+ легко. Почему?
в) Соединения 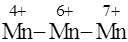 - окислители
- окислители
3.3. Взаимодействие с кислотами
а) Mn + 2H+ + 6H2O = [Mn(H2O)6]2+ + H2 (HClразб, H2SO4, разб.),
б) HNO3, конц – пасс.
в) Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
50 %- ная
г) 3Э + 7HNO3 = 3HЭО4 + 7NO + 2H2O; Э = Tc, Re
30%-ная
3.4.. Взаимодействие с галогенами
Mn + Г2 ® MnГ2; Tc + 2Cl 2 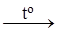 TcCl4; 2Re + 5 Cl2 → 2ReCl5
TcCl4; 2Re + 5 Cl2 → 2ReCl5
3.5. Взаимодействие с кислородом
Re + O2 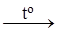
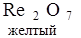
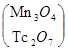
§ 4. Природные руды:
Mn ~ 10-1 % MnO2 × xH2O – пиролюзит
 10-7 Re в молибдените MoS2
10-7 Re в молибдените MoS2
§ 5. Свойства соединений Mn (II)
1. Mn2+ + 2OH- ® Mn(OH)2 ¯ (NH4 + + NH4OH)
белый осадок;
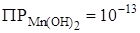 ; K b =5 10-5
; K b =5 10-5
2. Mn(OH)2 + 2KOHконц = К2[Mn(OH)4]
Комплексообразование усиливает кислотные свойства.
3. Mn2+ + O2 + H2O = 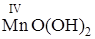
коричневый
4. Mn(OH)2 + Br2 + 2NaOH = MnO(OH)2 + 2NaBr
(BrO-) + H2O
 Сu2+
Сu2+
MnO
5. Tс2+; Re2+ не существуют
6. Переход Mn (II) → Mn(VII) (катализатор ионы Ag+)
|
= 2HMnO4+ 5(NH4)2SO4 + 7H2SO4
Малиновый
 2014-02-18
2014-02-18 574
574






