Если не вводить допущения о стационарности, то дифференциальное уравнение (6) нельзя решить, принимая d[ES] / dt = 0. Вместо этого необходимо провести интегрирование:
d[ES]
∫ ————————————————— = ∫ d t. (1.12)
k1 ∙ [E]О ∙ [S] − (k1 ∙ [S] + k−1 + k2) ∙ [ES]
Отсюда:
ln[k1 ∙ [E]О ∙ [S] − (k1 ∙ [S] + k−1 + k2) [ES] ]
—————————————————— = t + α. (1.13)
− (k1 ∙ [S] + k−1 + k2)
В момент начала реакции промежуточное соединение отсутствует, то есть [ES] = 0 при t = 0, и, следовательно,
ln(k1 ∙ [E]О ∙ [S])
α = ——————————, что дает следующее выражение:
− (k1 ∙ [S] + k−1 + k2)
k1 ∙ [E]О ∙ [S] − (k1 ∙ [S] + k−1 + k2)
ln ——————————————— = − (k1 ∙ [S] + k−1 + k2) ∙ t. (1.14)
k1 ∙ [E]О ∙ [S]
Преобразуя выражение (1.14), получим
(k1 ∙ [S] + k−1 + k2) ∙ [ES]
1 − ——————————— = exp [− (k1 ∙ [S] + k−1 + k2) ∙ t]. (1.15)
k1 ∙ [E]О ∙ [S]
Следовательно,
k1 ∙ [E]О ∙ [S] ∙ {1 − exp [− (k1 ∙ [S] + k−1 + k2) ∙ t]}
[ES] = ————————————————————— и
k1 ∙ [S] + k−1 + k2
υm ∙ [S] ∙ {1 − exp [− (k1 ∙ [S] + k−1 + k2) ∙ t]}
υО = —————————————————————, (1.16)
Km + [S]
где величины υm и Km определяются также, как и ранее, то есть υm = k2 ∙ [E]О и
k−1 + k2
Km = ———— соответственно.
k1
При достаточно больших значениях времени (t), когда экспоненциальный член уравнения становится бесконечно малым, выражение (1.16) превращается в более простое уравнение стационарной скорости (1.9):
υm ∙ [S]
υО = ————.
Km + [S]
Значения времени (t), при которых это происходит, зависят от величины (k1 ∙ [S] + k−1 + k2). Для большинства ферментативных реакций справедливо уравнение (1.9), и это можно рассматривать как доказательство того, что, как правило, величина (k1 ∙ [S] + k−1 + k2) намного больше, чем 1 с−1.
Уравнение (1.16) было получено Лейдлером как частный случай. Лейдлер рассмотрел ситуацию, когда реакция протекает достаточно долго и вследствие этого концентрация субстрата понижается настолько, что допущение о постоянстве [S] и равенстве ее [S]о (начальной величине [S]) перестает выполняться. Он нашел, что в данном случае система достигает стационарного состояния, в котором
k1 ∙ [E]О ∙ ([S]О − [P])
[ES] = ——————————, (1.17)
k1 ∙ ([S]О − [P]) + k−1 + k2
и, следовательно
k1 ∙ [E]О ∙ ([S]О − [P]) υm ∙ ([S]О − [P])
υО = ———————————— = ——————————. (1.18)
k1 ∙ ([S]О − [P]) + k−1 + k2 Km + [S]О − [P]
Уравнения (1.17) и (1.18) идентичны уравнениям (1.7) и (1.9), за исключением того, что величина [S] в последних заменена на ([S]О − [P]). Подводя итог вышесказанному, можно отметить, что кинетическая кривая ферментативной реакции обычно состоит из трех участков, разграниченных во времени (рис. 1.2.).
Переходный участок I кривой описывается уравнением (1.16); далее следует стационарный участок, горизонтальный отрезок II которого описывается уравнением стационарной скорости Михаэлиса-Ментен (1.9); затем идет участок основного протекания реакции III, который описывается уравнением (1.18).
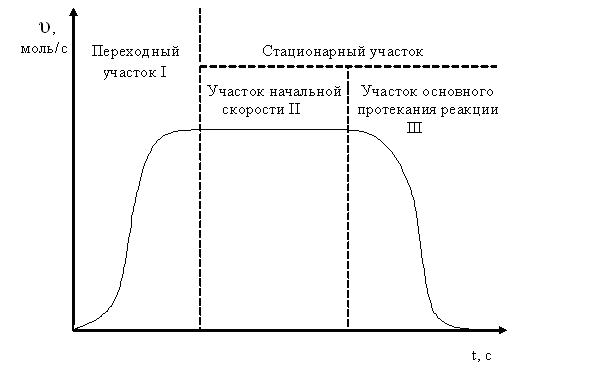
Рис. 1.2.Временной ход реакции, подчиняющийся механизму Михаэлиса-Ментен.
До сих пор при выводе уравнений скорости предполагалось, что [S]О >> [E]О. Такая ситуация имеет место на практике при изучении кинетических кривых. Лейдлер в своих исследованиях рассмотрел вопрос о том, к чему приведет допущение о стационарном протекании реакции при менее жестких ограничениях. Он пришел к выводу, что при выполнении, по крайней мере, одного из следующих допущений:
1. [S]О >> [E]О;
2. [E]О >> [S]О;
3. (k−1 + k2) >> k1 ∙ [E]О;
4. (k−1 + k2) >> k1∙ [S]О
уравнение скорости принимает вид, несколько отличный от уравнения (1.18):
υm ∙ ([S]О − [P])
υО = ——————————. (1.19)
Km + [S]О + [E]О − [P]
Поскольку в экспериментальных условиях есть свобода большого выбора значений [E]О и [S]О, добиться выполнения хотя бы одного из четырех условий не составляет труда.
 2014-02-18
2014-02-18 308
308






